薬機法とは!?薬機法改正について
薬機法とは、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」のことで、医薬品医療機器等法、薬機法と略される。
日本における医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品に関する運用などを定めた法律である。
制定当初は「薬事法」(やくじほう)であったが、2014年に薬事法等の一部を改正する法律の施行により現在の「薬機法」(やっきほう)に改められた。
薬機法では、行政の承認や確認、許可、監督等のもとでなければ、医薬品や医薬部外品、化粧品、医療機器の製造や輸入、調剤で営業してはならないよう定めている。
2019年12月4日に改正薬機法が公布され、2020年9月1日より、改正薬機法の関連省令が施行された。
改正薬機法の内容は、4つの大項目から成る。
①医薬品、医療機器等をより安全・迅速・効率的に提供するための開発から市販後までの制度改善
②住み慣れた地域で患者が安心して医薬品を使うことができるようにするための薬剤師・薬局のあり方の見直し
③信頼確保のための法令遵守体制等の整備
④その他

①医薬品、医療機器等の開発から市販後までの制度改善
・厚生労働省の通知に基づいて運用されている「先駆け審査指定制度」、「条件付き早期承認制度」を法律に基づく制度とする。
・「先駆け審査指定制度」は、世界に先駆けて日本で申請しようとする画期的新薬を承認審査で優遇する制度。医薬品医療機器総合機構(PMDA)が申請資料を事前に評価することで実質的に審査を前倒しし、通常12カ月かかる審査を半分の6カ月に短縮する。
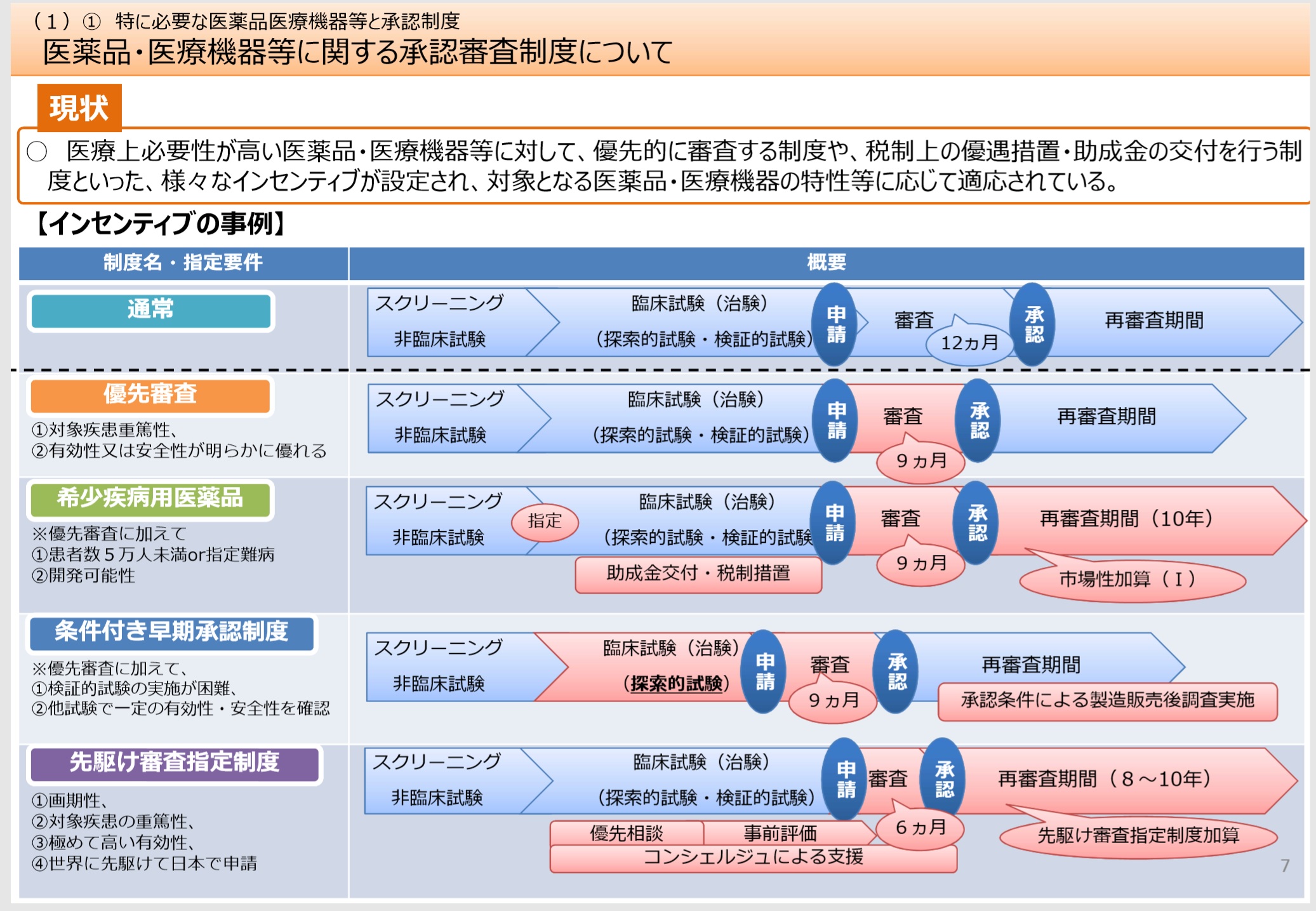
・「条件付き早期承認制度」は、重篤で有効な治療法がないうえ、患者数が少ないなどの理由で検証的臨床試験(一般的には臨床第3相〈P3〉試験)を行うのが難しい疾患が対象となる。
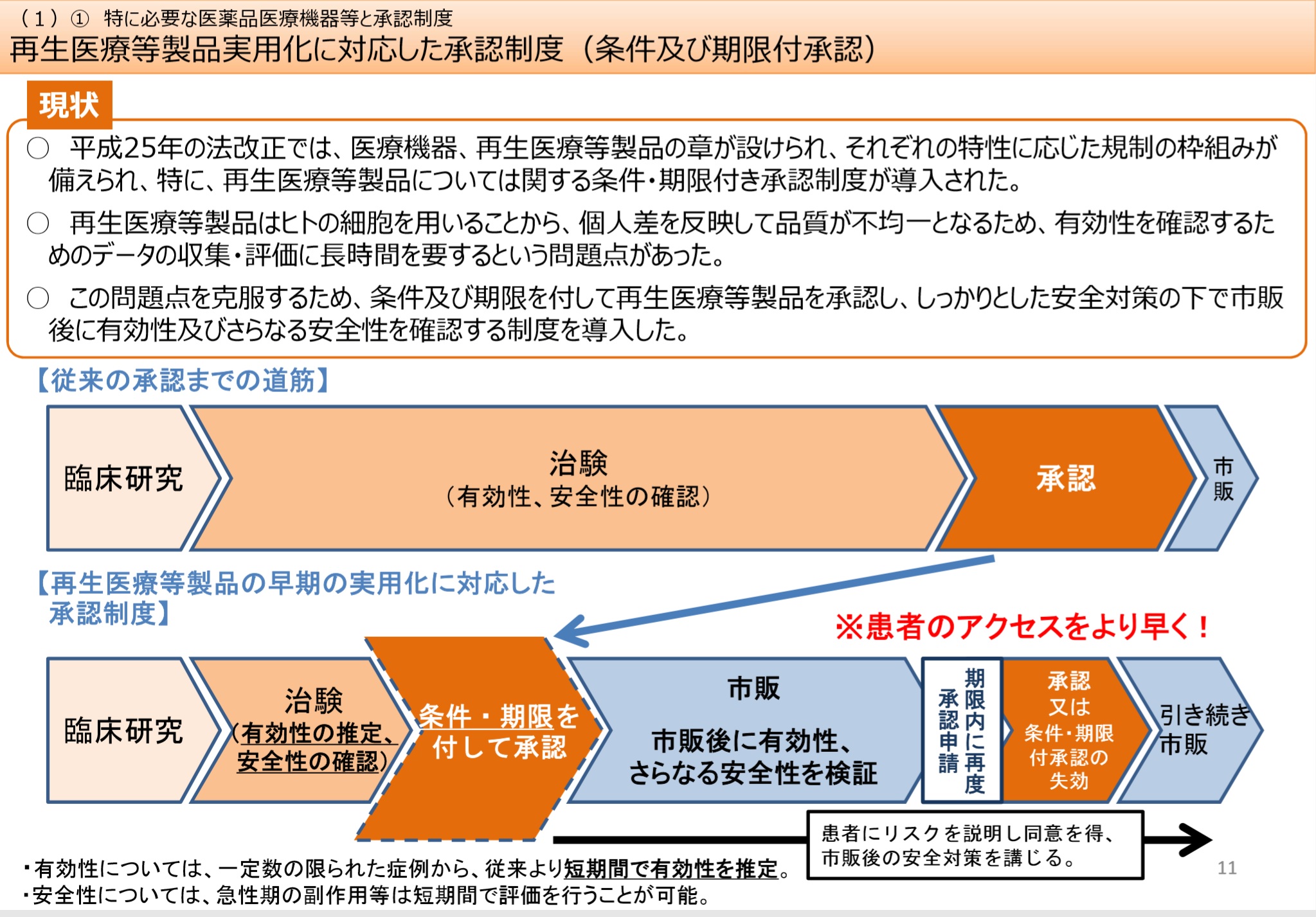
検証的試験以外の試験で有効性・安全性がある程度示されれば、発売後に有効性・安全性をあらためて確認することを条件に、検証的試験を行わなくても承認する制度である。
・最終的な製品の有効性、安全性に影響を及ぼさない医薬品等の製造方法等の変更について、事前に厚生労働大臣が確認した計画に沿って変更する場合に、承認制から届出制に見直す。
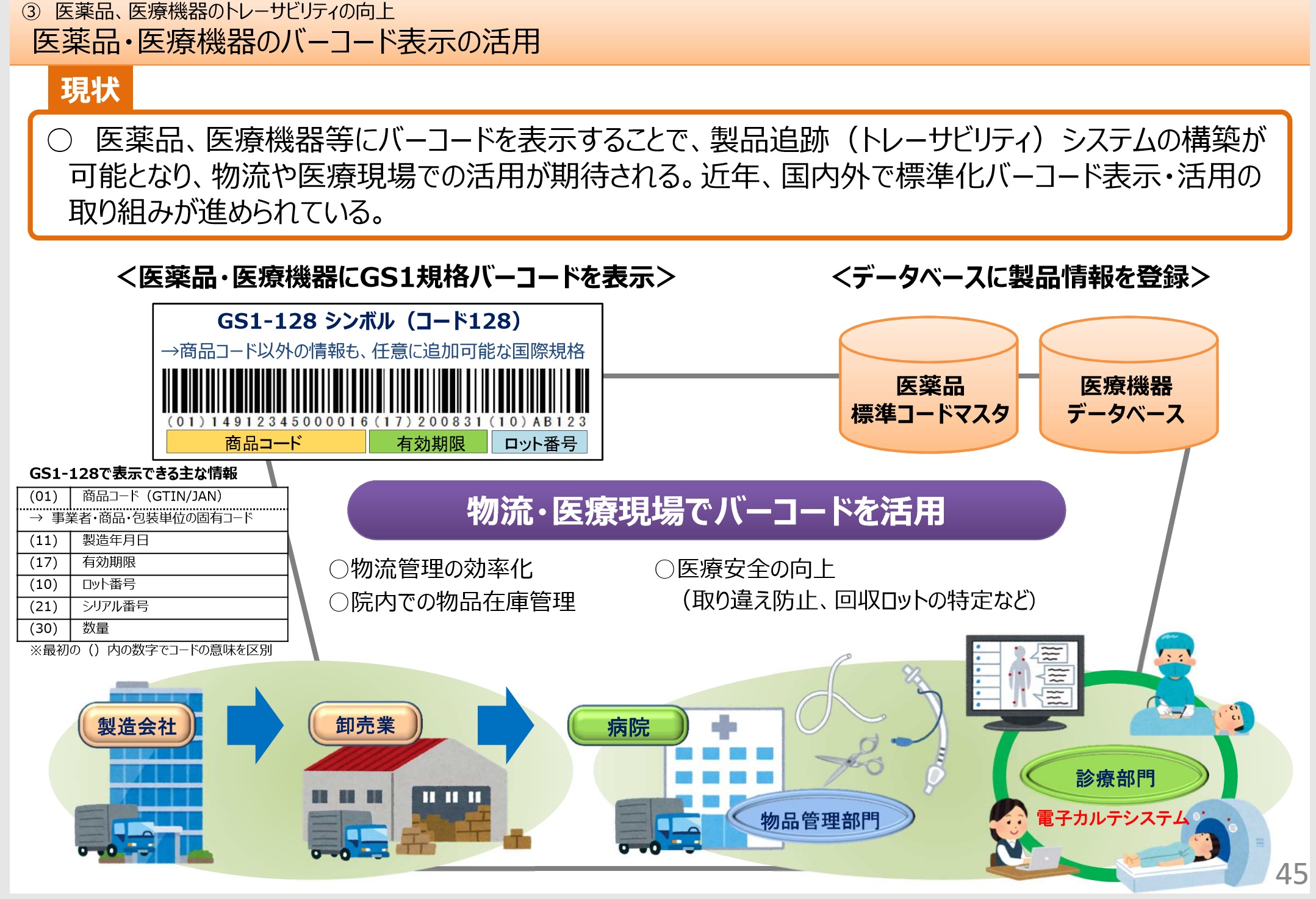
・トレーサビリティ向上のため、医薬品 等の包装等へのQRコードやバーコード等の表示の義務付けなど、医薬品、医療機器等をより安全・迅速・効率的に提供するための開発から市販後までの制度改善を行う。

・製品納品時の紙で同梱されている医療用医薬品の添付文書の同封を廃止する。医療現場に対する最新情報の提供は原則電子化することとなる。
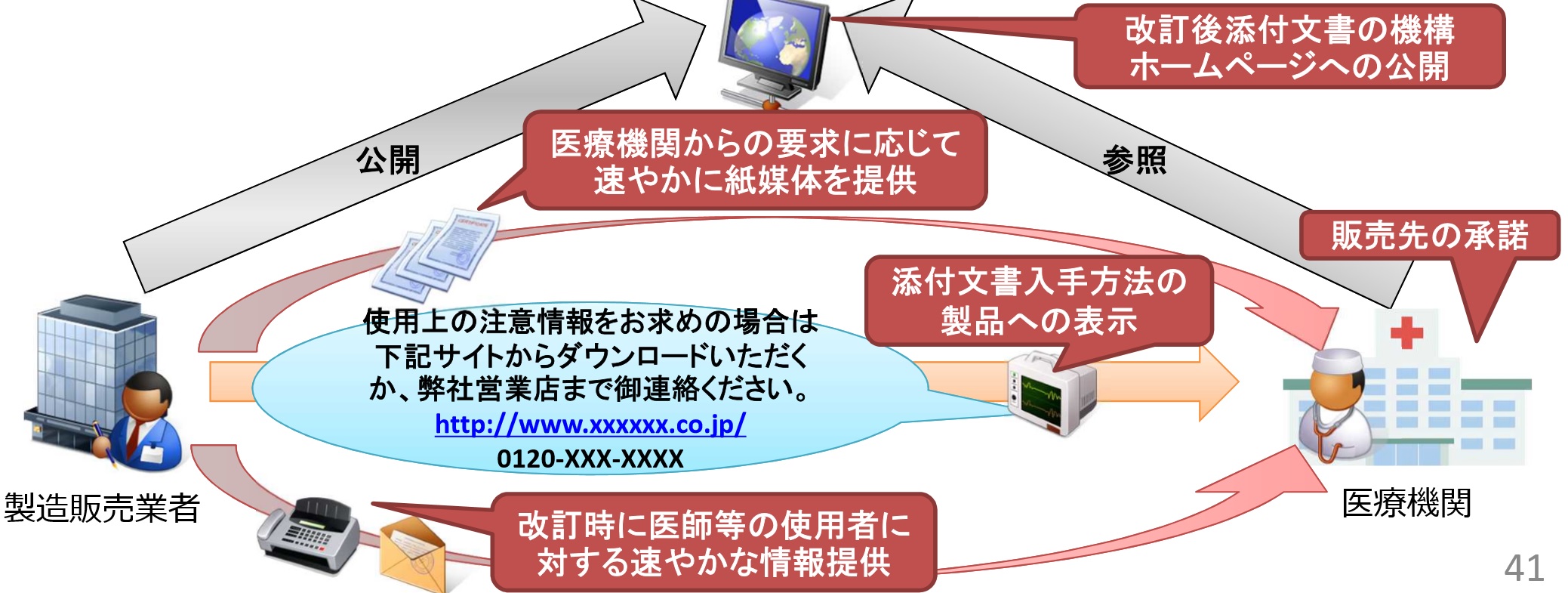
これに伴い、スマートフォンやタブレットなど端末を活用し、医療機関や薬局等に情報を確実に届ける仕組みの構築が求められる。
添付文書の改訂は頻繁に行われており、常に最新のものにアクセスできるようにするのが狙いである。
・国際的な規制の整合性を確保するため、GMP適合性調査やQMS適合性調査を見直す。
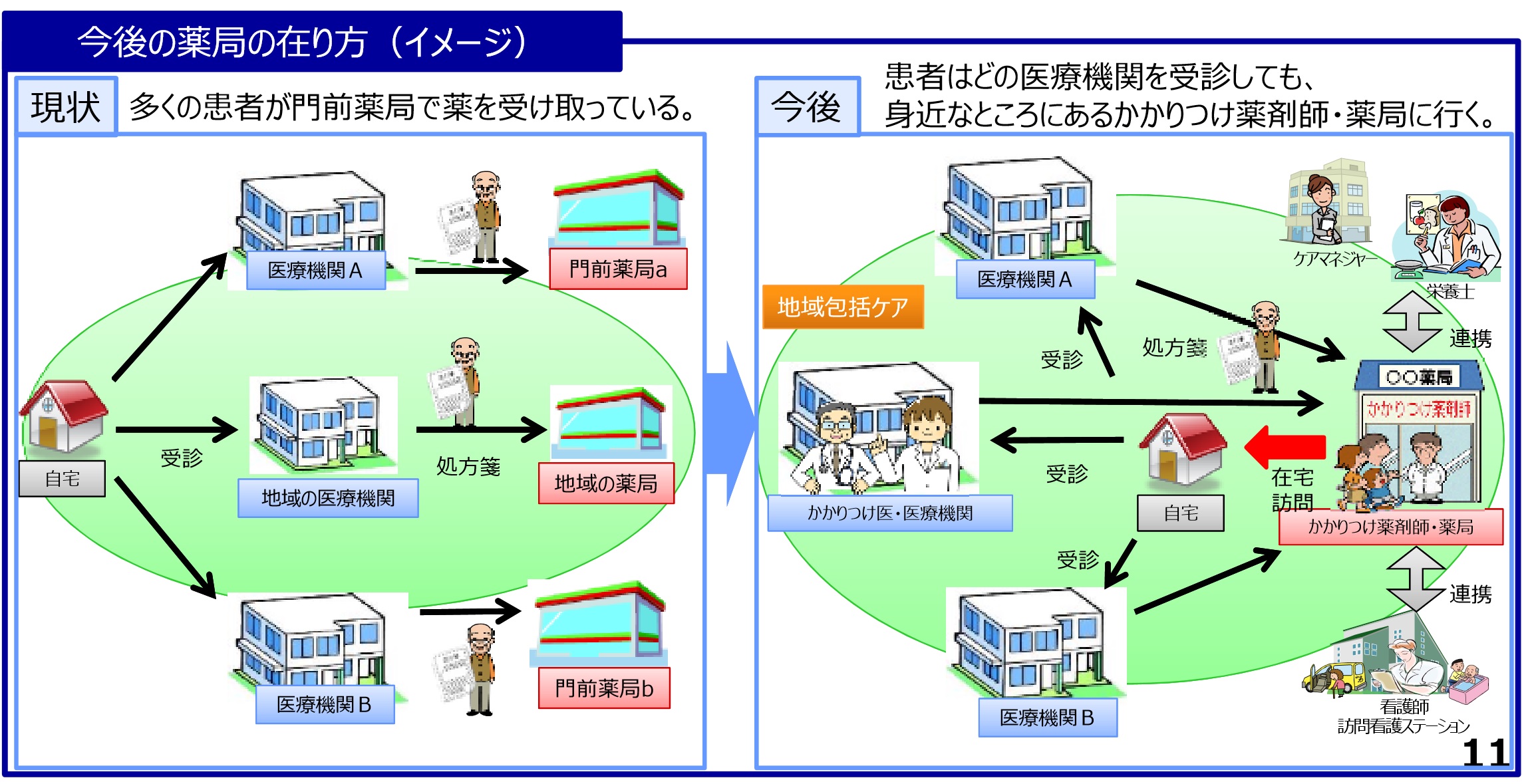
②薬剤師・薬局のあり方の見直し
・薬剤師が、調剤時に限らず、必要に応じて患者の薬剤の使用状況の把握や服薬指導を行う義務を法制化する。
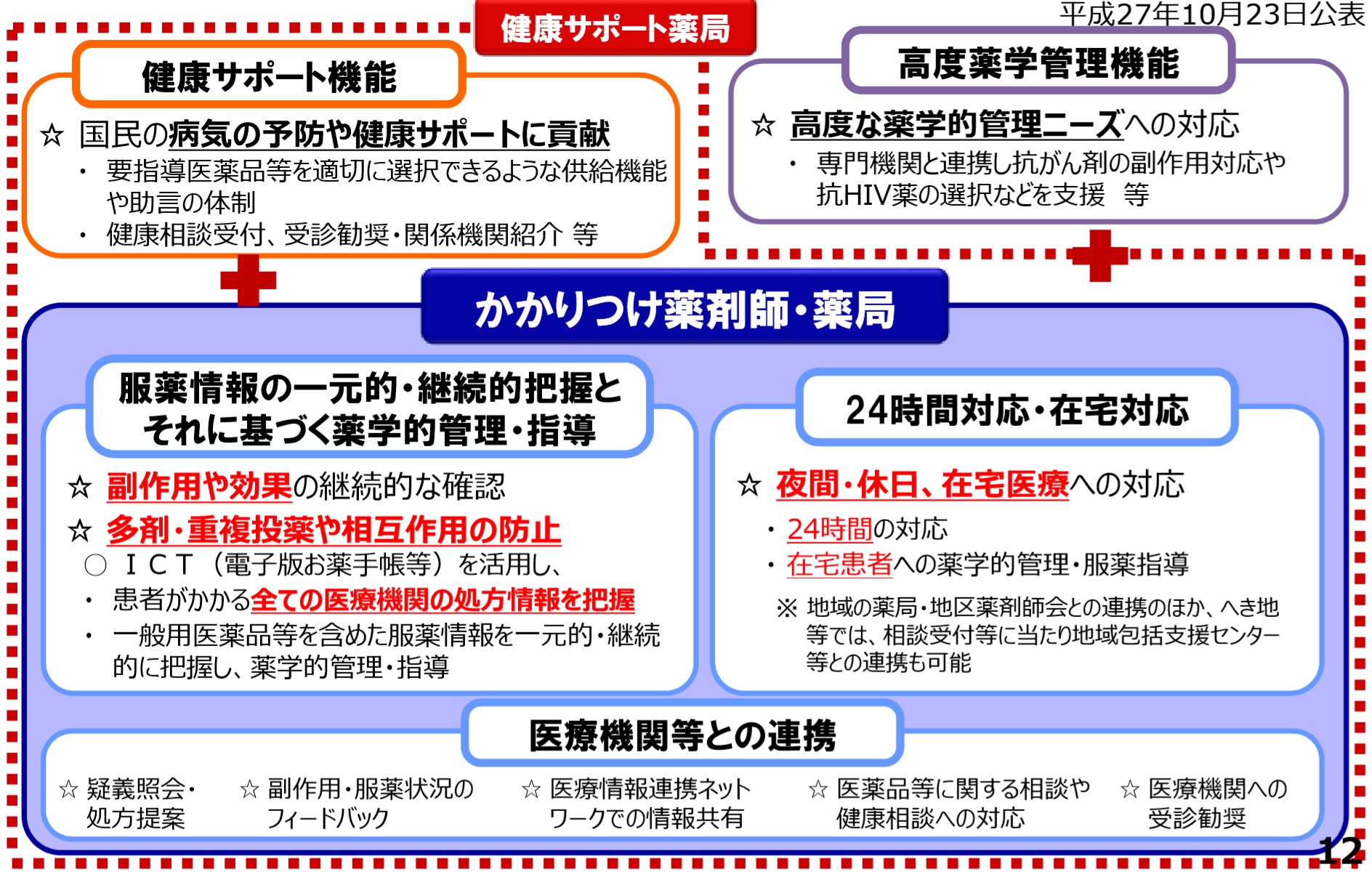

・患者が自身に適した薬局を選択できるよう、機能別の薬局の都道府県知事の認定制度(名称独占)を導入する。
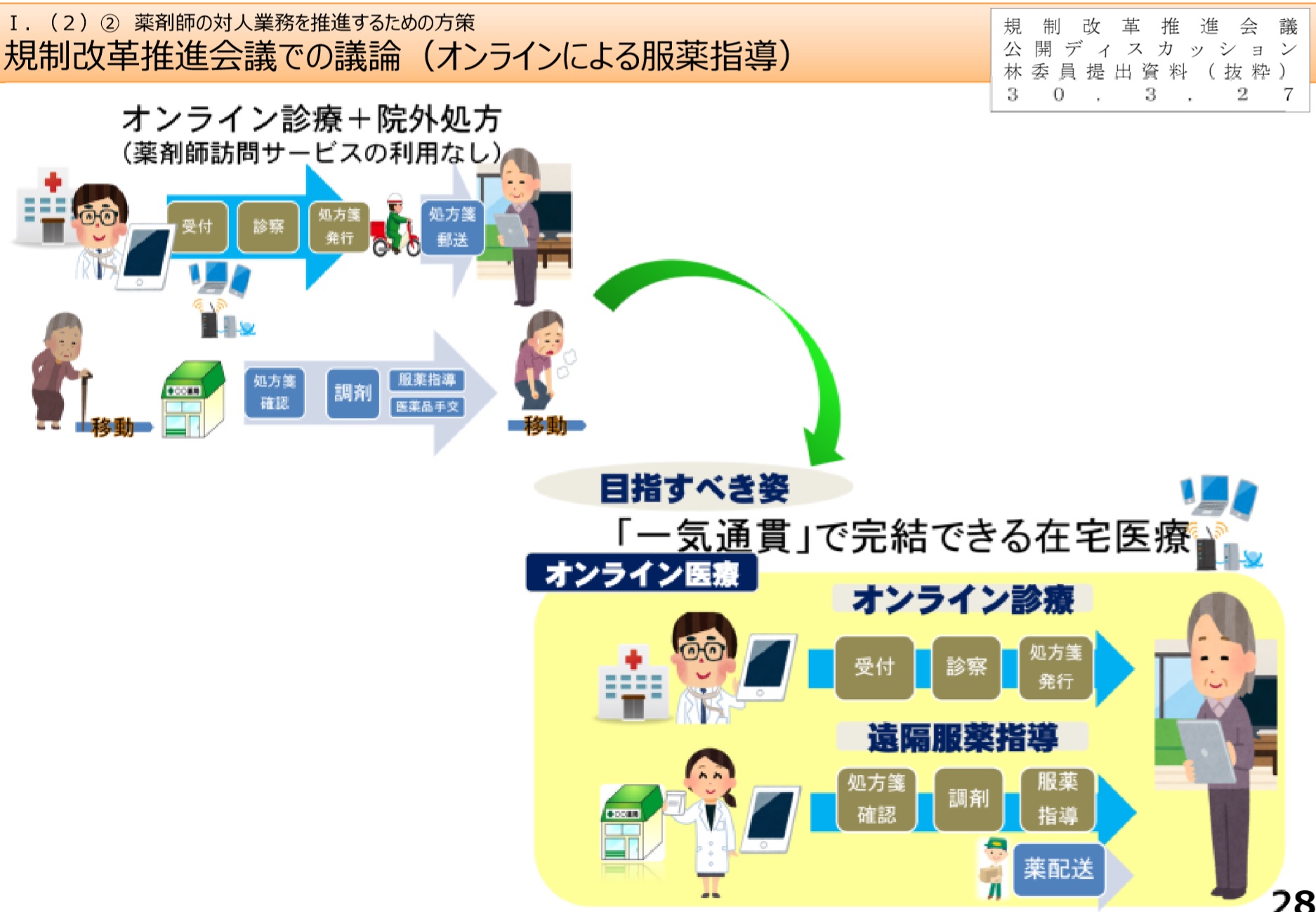
・服薬指導について、対面義務の例外として、一定のルールの下で、テレビ電話による服薬指導を規定する。
③法令遵守体制等の整備
・関係事業者の重大な法令違反で特に改善が必要な場合の役員変更命令や、虚偽・誇大広告による医薬品等の販売に係る課徴金制度の創設など、関係事業者による信頼確保のための法令遵守体制等の整備を行う。
・新たに設ける課徴金制度では、虚偽・誇大広告を行った製薬企業などに対し、違反行為を行った期間を対象に、該当する製品の売上高の4.5%を課徴金として徴収する。

自主的に違反を申告した場合は課徴金を半分に減額するほか、業務改善命令や業務停止命令を行った場合は課徴金の納付を命じないこともある。
④その他
・医薬品等行政評価・監視委員会の設置。
・血液法を改正し、科学技術の発展を踏まえた採血等の制限の緩和を行うなどの見直しを行う。
| 製造の知識 | GMPの知識 |
|---|---|
|
医薬品製造の流れ等 |
GMPとは!?等 |
| 品質管理の知識 | 回収事例・クレームの知識 |
|---|---|
|
バリデーションとは!?等 |
回収とは!?不正製造事例等 |
| くすりの知識 | 設備・環境の知識 |
|---|---|
|
良い医薬品とは!?原薬とは!?等 |
製造に適した作業室とは!?等 |
| 新着トピックス | 部門と作業員の知識 |
|---|---|
|
新着の話題・動向 |
作業員に求められることとは!?等 |
関連レポート
- GMPとは!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。GMPとは!?医薬品をつくる工程で大切なことをまとめました。
- GMPの3原則とは!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。GMP3つの基本要件とは?GMP3原則とは!?医薬品をつくる工程で大切なことをまとめました。
- GMP省令(原文)
- 医薬品製造に関わる基礎知識をまとめて紹介します。GMP省令(原文)とは!?医薬品の品質管理、医薬品をつくる工程で大切なことをまとめました。
- なぜGMPが必要なのか!?(ヒューマンエラーの対策)
- 医薬品製造に関わる基礎知識をまとめて紹介します。なぜGMPが必要なのか!?(ヒューマンエラーの対策)医薬品をつくる工程で大切なことをまとめました。
- 従業員がGMPを守るためには!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。作業者がGMPを守るためには?医薬品をつくる工程で大切なことをまとめました。
- 医薬品製造に必要な標準書・基準書・手順書
- 医薬品製造に関わる基礎知識をまとめて紹介します。医薬品製造に必要な標準書・基準書・手順書は?医薬品をつくる工程で大切なことをまとめました。
- バリデーションの記録
- 医薬品製造に関わる基礎知識をまとめて紹介します。信用できる記録とは!?医薬品をつくる工程で大切なことレポートにまとめました。
- データインテグリティとは!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。データインテグリティとは?医薬品をつくる上で大切なことをレポートにまとめました。
- GMP査察の指摘事例は!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。GMP査察の指摘事例は!?をレポートにまとめました。
- GMPを違反したらどうなるのか!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。GMPを違反したらどうなるのか!?医薬品をつくる工程で大切なことレポートにまとめました。
- GMP指摘事例速報(オレンジレター)とは!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。GMPを違反したらどうなるのか!?医薬品をつくる工程で大切なことレポートにまとめました。
- GMP省令の取扱い(原文)
- 医薬品製造に関わる基礎知識をまとめて紹介します。GMP省令の取扱い(原文)とは!?医薬品の品質管理、医薬品をつくる工程で大切なことをまとめました。
- 日本の医薬品製造の法体系とは!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。日本の医薬品製造の法体系についてまとめました。
- 添付文書閲覧アプリ「添文ナビ」 とは!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。添付文書閲覧アプリ「添文ナビ」 とは!?薬機法改正についてまとめました。
- 逸脱(いつだつ)とは!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。逸脱(いつだつ)とは!?医薬品の品質管理、医薬品をつくる工程で大切なことをまとめました。
- 逸脱(いつだつ)発生時の対応は!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。逸脱(いつだつ)発生時の対応は!?医薬品の品質管理、医薬品をつくる工程で大切なことをまとめました。
- 逸脱(いつだつ)の原因調査・CAPAの実施
- 医薬品製造に関わる基礎知識をまとめて紹介します。逸脱(いつだつ)の原因調査・CAPAの実施。医薬品の品質管理、医薬品をつくる工程で大切なことをまとめました。
- 無通告査察とは!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。無通告査察とは!?無通告査察での指摘事例をレポートにまとめました。
- 無通告査察での指摘事例
- 医薬品製造に関わる基礎知識をまとめて紹介します。無通告査察とは!?無通告査察での指摘事例をレポートにまとめました。
- PMDAと厚生労働省の違いとは!?
- 医薬品製造に関わる基礎知識をまとめて紹介します。PMDAと厚生労働省の違いとは!?医薬品の品質管理、医薬品をつくる工程で大切なことをまとめました。







