なぜ手順書が必要なのか?
文書化体系(標準書・手順書)の目的と運用原則
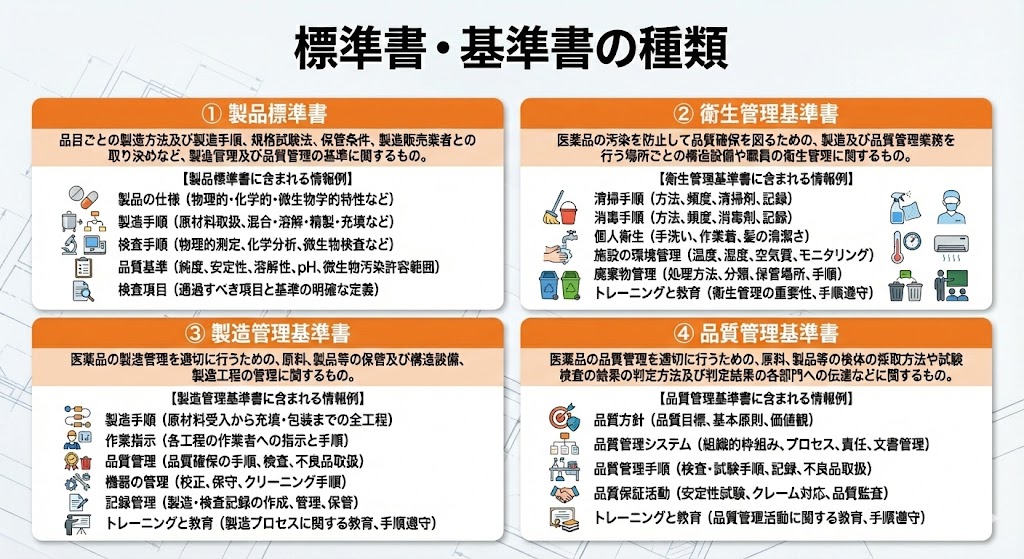
GMPにおける文書類(ドキュメント)は、製造や検査のプロセスを明確に定義し、品質保証システムの基盤となるものである。
これらを遵守することで、属人化を防ぎ、製品の恒常的な品質(Quality Consistency)が確保される。
【標準書・基準書】の必要性
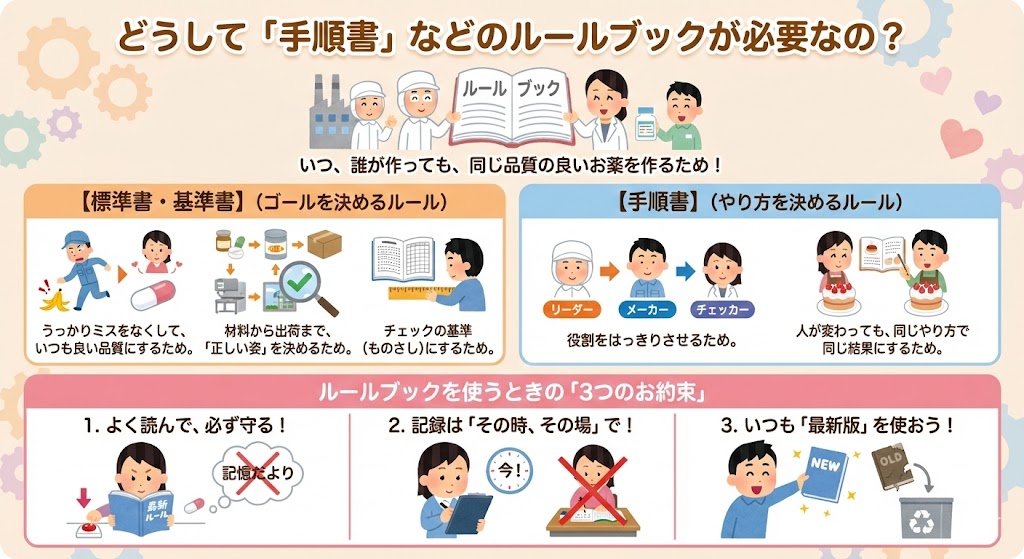
・ヒューマンエラーを排除し、常に均一な品質の医薬品を製造するため。
・原料・資材の受入から製造、保管、出荷に至る全工程において、構造設備、製造環境、品質試験等の「あるべき姿(適正な管理基準)」を規定するため。
・製造および試験記録の正確性を担保し、品質確認を確実に行うための判定基準とするため。
【手順書】の必要性
・製造管理者や責任者の役割と責任を明確化し、組織的な品質保証体制を確立するため。
・出荷判定、バリデーション、変更管理、逸脱管理、教育訓練などの重要業務について、担当者が変わっても同じ結果が得られるよう(再現性の確保)、具体的な実行プロセスを標準化するため。
また、これらの文書運用においては、以下の三原則を徹底しなければならない。
1. 文書の完全な理解と遵守
人間の記憶は不確かであり、記憶に頼った作業はミスの温床となる。
すべての作業は、該当する最新の文書を熟読・理解した上で、記載された条件・手順通りに実施する。
手順の遵守は、担当者の技量に左右されない「品質の再現性」を保証する唯一の手段である。
2. データインテグリティ(記録の同時性・正確性)
記録は、作業が正しく行われたことを証明する唯一の証拠である。
記憶に頼って後から書くのではなく、作業を行った「その時、その場」で正確に記録を残すこと。これが逸脱発生時の原因究明や品質保証の鍵となる。
3. 最新版管理の徹底
作業条件や手順に変更が生じた場合は、変更管理手続きを経て速やかに文書を改訂する。
現場には常に最新版のみを配置し、旧版による誤った作業を物理的に防止しなければならない。