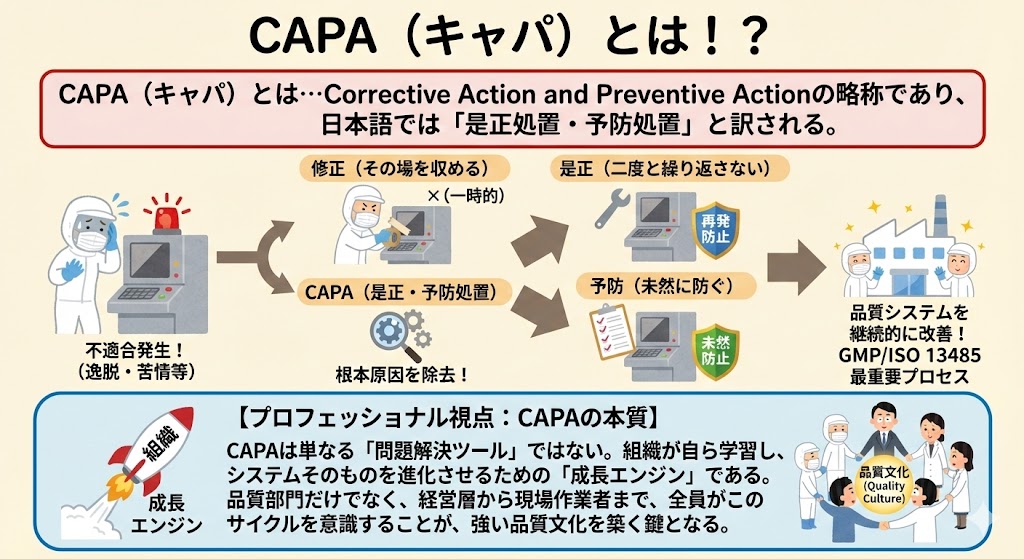
逸脱(いつだつ)の原因調査・CAPAの実施
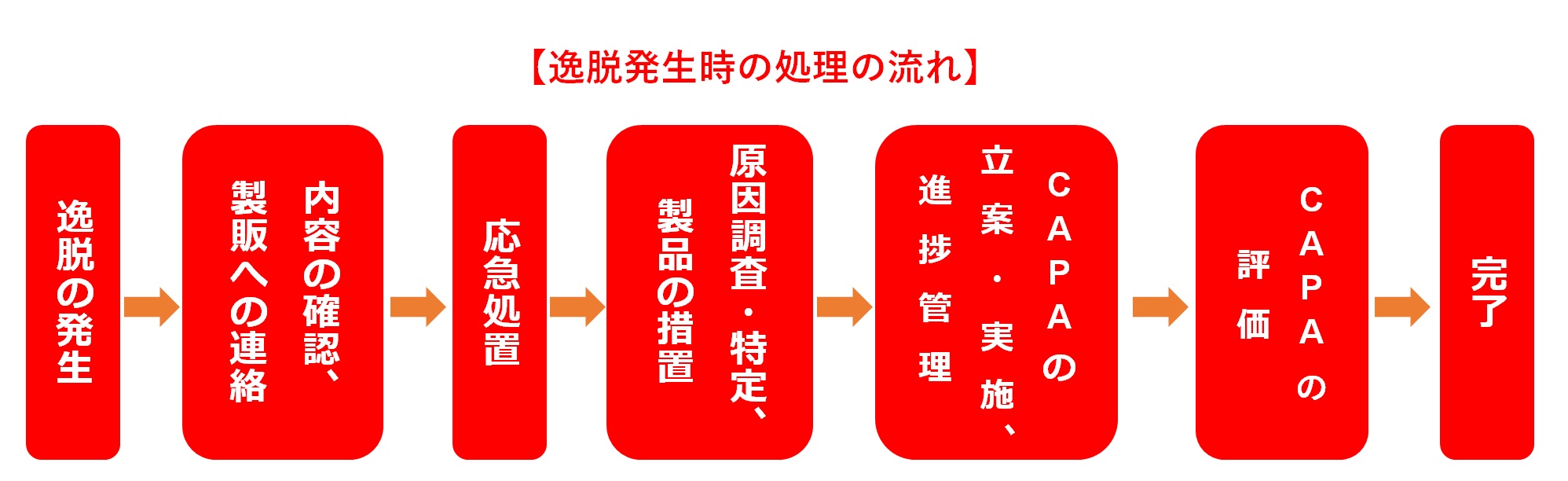
逸脱が発生した場合、応急処置(拡大防止)を実施するだけでなく、製品品質への影響を科学的に調査し、出荷の可否(Disposition)や市場回収(リコール)の必要性の有無を判断する。
同時に、直接原因および根本原因を特定し、それらに対して的確で妥当性のある是正処置・予防処置(CAPA)を実行しなければならない。
根本原因調査・特定および製品の措置
逸脱管理において原因調査は最重要プロセスであり、組織として迅速に取り組む必要がある。
調査においては、人(Man)、設備(Machine)、原材料(Material)、方法(Method)、環境(Environment)のいわゆる「4M+1E」の視点から多面的に要因を分析する。
直接的な原因(Direct Cause)だけでなく、その背後にある潜在的な要因(Root Cause)を含めて深く掘り下げることが不可欠である。
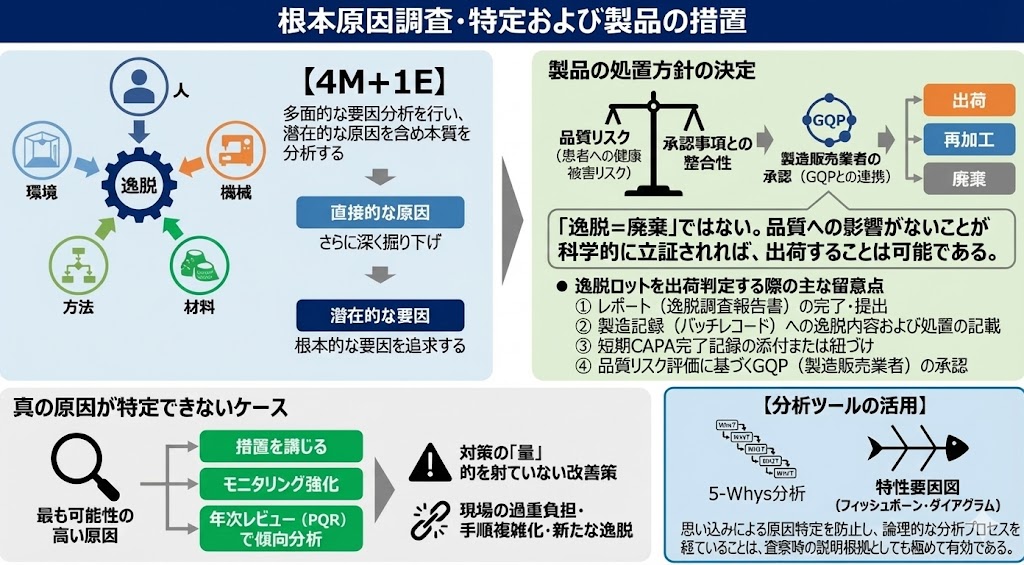
原因が明確になれば、製品の処置方針を決定する。
逸脱の影響が当該ロット、他ロット、あるいは他製品へどの程度及んだかを的確に把握し、品質リスク(患者への健康被害リスク)および承認事項との整合性の両面から、最終的なロットの取り扱い(出荷、再加工、廃棄等)を決定する。
必要に応じ、製造販売業者の承認(GQPとの連携)を得るプロセスも重要である。
「逸脱=廃棄」ではない。品質への影響がないことが科学的に立証されれば、出荷することは可能である。
逸脱ロットを出荷判定する際の主な留意点は以下の通りである。
①逸脱調査報告書が完結し、提出されていること
②製造記録に逸脱内容および処置の記載があること
③CAPAが短期的に完了する場合、その実施記録が製造記録に添付または紐づけられていること
④品質リスク評価に基づき、製造販売業者の承認(出荷指図)を得ていること
徹底的な調査を行っても、真の原因が特定できないケースも存在する。
この場合は、最も可能性の高い原因(Most Probable Cause)を特定し、それを取り除く措置を講じる。その上で、再発の有無を確認するためにモニタリングを強化し、年次レビュー(PQR:製品品質照査)等の機会を用いて傾向分析を行う必要がある。
注意すべきは、対策の「量」ではない。的を射ていない改善策を乱発すれば、現場に過重な負担を強いることになり、手順が複雑化して新たな逸脱を招く原因となる。
【分析ツールの活用】
「なぜ?」を繰り返す「5-Whys分析」や、要因を網羅的に洗い出す「特性要因図(フィッシュボーン・ダイアグラム)」などのQC手法を活用することで、思い込みによる原因特定を防ぐことができる。論理的な分析プロセスを経ていることは、査察時の説明根拠としても極めて有効である。
CAPAの立案と実施
CAPA活動は、実効性のある計画を立案することから始まる。
アプローチは各社各様であるが、根本原因を除去するものでなければ意味がない。
適切なCAPA活動によるメリットは以下の通りである。
・逸脱の再発リスクを著しく低減できる
・品質トラブルによる生産性低下やコスト損失を防ぐことができる
・ノウハウが蓄積され、技術力および組織能力の向上が期待できる
・GMP順守状況や品質システム(PQS)をより強固なものにできる
CAPAの計画および実施完了に対しては、必ず品質保証部門(QA)による妥当性の評価と承認を経る必要がある。
【対策の優先順位】
CAPAには効果の高さによる階層がある。「手順書を書き換えて再教育(管理的対策)」は最も効果が低く、再発しやすい。可能な限り「設備改造によるエラー防止(物理的対策)」や「工程そのものの見直し(除去)」といった、人の注意に依存しない対策を選択すべきである。
CAPAの進捗管理
立案後は、5W1Hを明確にしたCAPA実施計画書を作成し、その進捗を追跡管理(トラッキング)する。
CAPAの進捗を常に管理された状態(Under Control)にしておくことは、品質部門の重要な責務である。
放置すれば、期限超過(Overdue)が常態化し、最悪の場合、未完了のまま忘れ去られるリスクがある。
妥当性のあるCAPAを確実に実行するため、実施部門と品質部門は緊密に連携し、期限内の完了を目指す。
CAPAの有効性評価
CAPA完了後、一定期間を経て「再発していないか」「新たなリスクが生じていないか」を確認する。CAPAの有効性評価(Effectiveness Check)こそが、サイクルの要である。
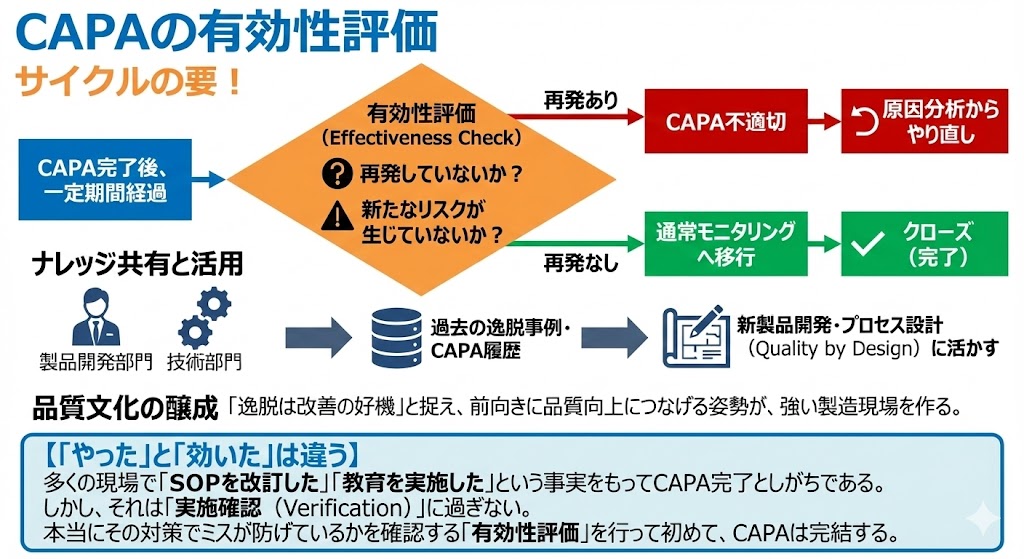
再発した場合は、CAPAが不適切であったと判断し、原因分析からやり直す必要がある。
再発がなければ、通常のモニタリングへ移行し、当該案件をクローズ(完了)とする。
また、製品開発部門や技術部門は、過去の逸脱事例やCAPAの履歴をナレッジとして共有することで、新製品の開発や製造プロセスの設計(Quality by Design)に活かすことができる。
「逸脱は改善の好機」と捉え、前向きに品質向上につなげる姿勢(Quality Culture)が、強い製造現場を作る。
【「やった」と「効いた」は違う】
多くの現場で「SOPを改訂した」「教育を実施した」という事実をもってCAPA完了としがちである。しかし、それは「実施確認(Verification)」に過ぎない。本当にその対策でミスが防げているかを確認する「有効性評価」を行って初めて、CAPAは完結する。