データインテグリティ・ALCOA原則とは!?
データインテグリティの定義と必要性
データインテグリティ(Data Integrity: DI)とは、「データの完全性」と訳され、米国食品医薬品局(FDA)においては「データが完全で、一貫性があり、かつ正確であること」と定義されている。
具体的には、好都合な試験データのみを残存させ、不適合データを削除するといった不正行為の防止、あるいは不正を疑われるような行為を未然に防ぐことが、データインテグリティの本質である。
データインテグリティは、必ずしも新規の要求事項ではない。従来のGMP要件において、データの完全性および正確性に対するリスクを再評価し、より強固で適切なデータ管理システムの構築を求める概念であると解釈される。
近年、データの改ざんや偽装といった不適切な事案が世界規模で発生している。
製薬業界も例外ではなく、FDAによるデータインテグリティ関連の指摘を含む警告書(Warning Letter)の発出件数は増加の一途を辿っている。
医薬品の品質、安全性、有効性の根拠となるデータの完全性と正確性が保証されない場合、当該企業の品質システムは機能不全であると見なされる。これは重大な品質問題を引き起こし、企業経営に甚大な損害を与えるリスクとなり得る。
ALCOA原則とALCOA+について
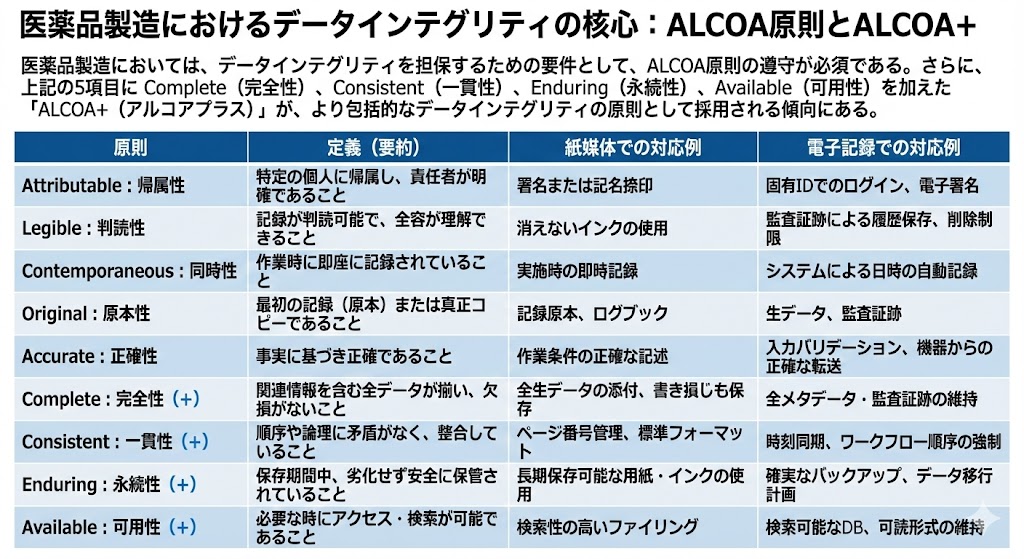
医薬品製造においては、製品の品質および患者の安全性を確保する上で、データの完全性(データインテグリティ:Data Integrity)が極めて重要な要素となる。このデータインテグリティを担保するための必須要件として、ALCOA原則の遵守が挙げられる。
さらに近年では、従来のALCOA 5項目に対し、Complete(完全性)、Consistent(一貫性)、Enduring(永続性)、Available(可用性)を加えた「ALCOA+(アルコアプラス)」が、より包括的かつ厳格なデータインテグリティの原則として採用される傾向にある。これは、データの生成から保管、維持、そして廃棄に至るまでのデータライフサイクル全体を通じた管理の重要性が高まっていることに起因する。
以下に、ALCOAおよびALCOA+を構成する各要素の定義と、紙媒体記録および電子記録それぞれにおける具体的な対応事例を示す。
| 原則 | 内容 | 紙媒体記録における対応 | 電子記録における対応 |
|---|---|---|---|
| Attributable (帰属性) |
記録が特定の個人に帰属し、責任の所在が明確であること | 作業者による署名または記名捺印 | 固有のID/パスワードによるログイン、電子署名 |
| Legible (判読性) |
全ての記録が判読可能であり、データの全容が理解できること | 黒または青色の消えないインクの使用 | 監査証跡(オーディットトレイル)による変更履歴の保存、データ削除の制限 |
| Contemporaneous (同時性) |
観察や作業が行われた時点で、即座に記録されていること | 作業実施時の即時記録 | システムによる日時情報の自動記録と保存 |
| Original (原本性) |
最初の記録(原本)、または原本の内容と意味を保持した真正コピーであること | GMP記録原本、ログブック | 全てのGMP生データ、監査証跡記録 |
| Accurate (正確性) |
記録が正確であり、事実に基づいていること | 実際の作業条件(誰が、何を、いつ、どのように)の正確な記述 | 入力データのバリデーション、機器からの正確なデータ転送 |
| Complete (+) (完全性) |
全てのデータ(メタデータ等の関連情報を含む)が揃っており、欠損がないこと | 全ての生データの添付、書き損じ記録も破棄せず保存 | 関連する全てのメタデータ、監査証跡の維持、再解析データの保存 |
| Consistent (+) (一貫性) |
記録の作成順序や論理に矛盾がなく、整合性が取れていること | 日付順のページ番号管理、標準化されたフォーマット | システム時刻の同期、ワークフロー順序の強制、タイムスタンプの整合性 |
| Enduring (+) (永続性) |
定められた保存期間中、記録が劣化せず安全に保管されていること | 長期保存可能な用紙・インクの使用(感熱紙のコピー保存等) | 堅牢なバックアップ媒体、データの移行(マイグレーション)計画 |
| Available (+) (可用性) |
必要な時にいつでも記録にアクセスでき、閲覧・検索が可能であること | 検索性の高いファイリング、アーカイブ管理台帳の整備 | 検索可能なデータベース、読み取り可能なファイル形式の維持 |
現場運用におけるデータインテグリティ確保の要諦
データインテグリティの侵害(DI違反)は、意図的な改ざ人のみならず、作業者の不注意やシステムの不備によっても発生し得る。したがって、ALCOA+を単なるチェックリストではなく「信頼性証明の論理的基盤」と捉え、以下の媒体別特性に留意した運用管理が求められる。
【媒体別の管理ポイント】
- 紙記録の場合:
「修正液や鉛筆の使用禁止」等の基本ルールに加え、書き損じを破棄せず訂正理由を付記する等、Complete(完全性)の担保を徹底する。 - 電子記録の場合:
共有アカウントの使用はAttributable(帰属性)を損なうため厳禁とする。併せて、システム時刻の同期(Consistent)や確実なバックアップ(Enduring)といったITインフラ管理を行う。
評価と改善のための2つの管理手法
DI確保の手段は、SOP(標準作業手順書)に基づく「手順管理(人的管理)」と、デジタル技術を活用した「技術管理(システム管理)」に大別される。
いずれの手法においても、単にルールやシステムを導入するだけでなく、継続的な教育訓練と監視体制の構築が不可欠である。
主な「技術管理」要件
技術的管理においては、以下の5機能の実装と運用が求められる。
・記録の保護:データの削除、改ざん、紛失からの保護
・アクセス管理:権限を持つユーザーのみによるアクセス制限(セキュリティ設定)
・監査証跡:データの作成、変更、削除に関する全履歴の自動記録
・電子署名:署名者、日時、理由の改変不可能な記録
・レポート機能:生データおよび分析結果の正確な出力と保管
データインテグリティ対応の根幹は、ALCOA原則の遵守にある。明確なデータガバナンス(管理方針)を策定し、それを実現するための「適切なシステム導入」と「運用管理」の両輪を回すことが重要である。


