GMP指摘事例速報(オレンジレター)とは!?
GMP指摘事例速報(オレンジレター)の概要
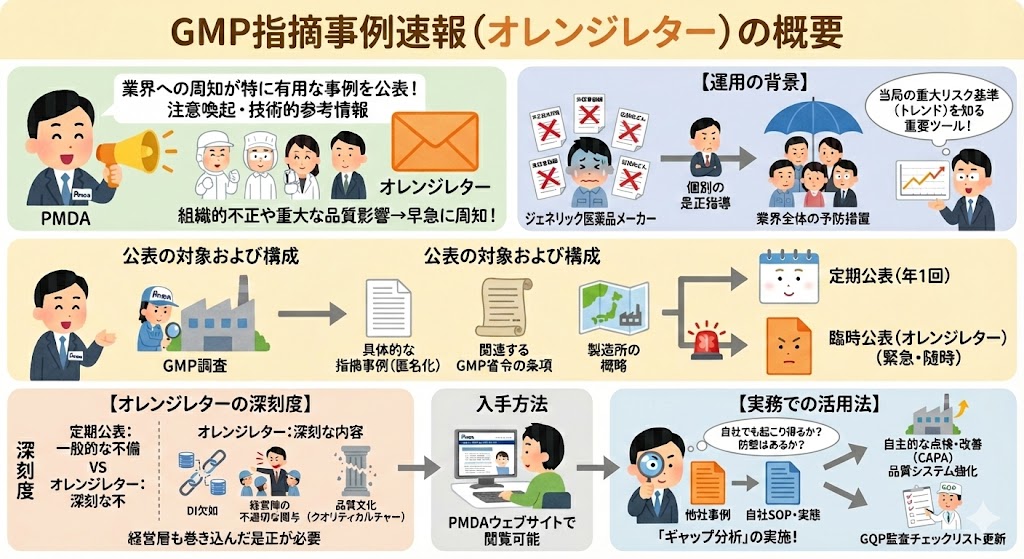
独立行政法人 医薬品医療機器総合機構 医薬品品質管理部(以下「PMDA」)は、令和4年4月よりGMP調査における指摘事項のうち、業界への周知が特に有用と考えられる事例について、注意喚起および技術的参考情報として公表する運用を開始した。
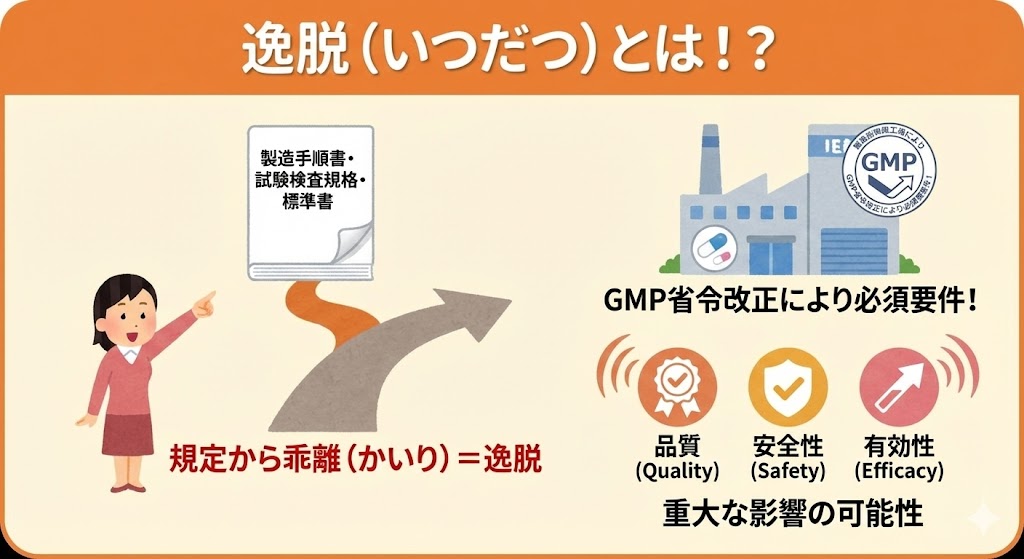
このうち、組織的な不正が認められた事例や、品質への重大な影響が懸念される事例等、早急に業界全体への周知・注意喚起が必要と判断され、随時公表されるものを「GMP指摘事例速報(オレンジレター)」と呼ぶ。

【運用の背景】
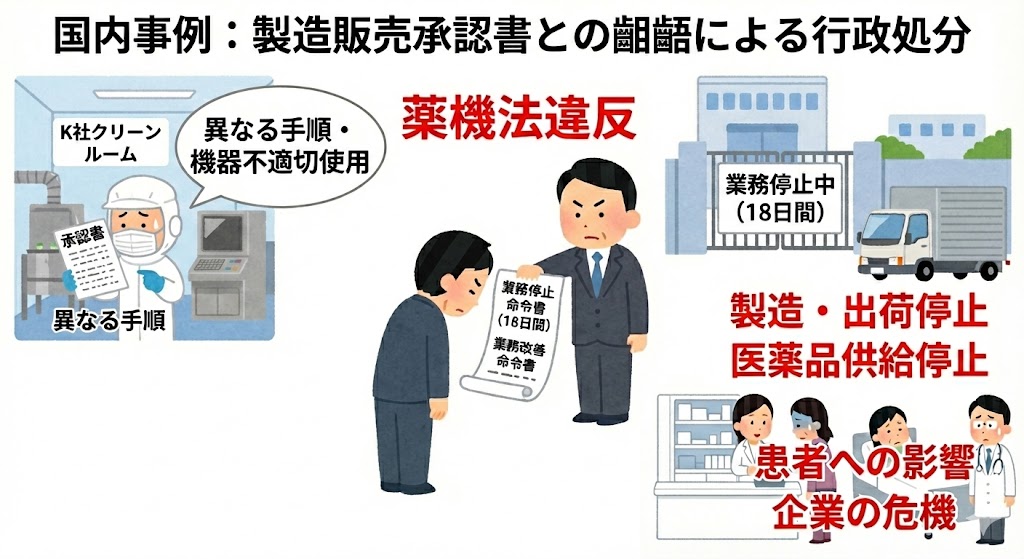
本制度開始の背景には、近年相次いだ後発医薬品メーカーによる不正製造問題(承認書との齟齬、記録改ざん等)がある。PMDAは従来の「個別の是正指導」から、業界全体での「予防措置」へと規制の舵を切ったといえる。現場責任者は、これを単なる「情報公開」と捉えず、当局が何を「重大なリスク」と見なしているかの基準(トレンド)を知るための最重要ツールとして認識する必要がある。
公表の対象および構成
公表の対象となるのは、PMDAが調査権限を行使して実施したGMP調査(実地調査等)である。
主な公表内容は以下の通りである。
・具体的な指摘事例(企業や製品が特定されないよう、適切に編集・加工されたもの)
・関連するGMP省令の条項
・製造所の概略(国内・海外の別、原薬・製剤の区分等)
公表形式には、年1回まとめて公表される「定期公表」と、緊急性が高く随時公表される「臨時公表(オレンジレター)」の2種類が存在する。

【オレンジレターの深刻度】
「定期公表」が一般的な不備事例の共有であるのに対し、「オレンジレター」として発出される事例は、データインテグリティ(DI)の欠如や、経営陣の不適切な関与など、企業の「品質文化(クオリティカルチャー)」そのものを問う深刻な内容であることが多い。これは現場レベルでの改善を超え、経営層も巻き込んだ是正が必要な事例であることを示唆している。
最新情報の入手方法と活用の意義
GMP指摘事例は、PMDAの公式ウェブサイトにて閲覧可能である。
他社の指摘事例を自社に置き換えて参照することで、医薬品等製造所における品質システムの強化や、自主的な改善活動(CAPA)の促進につなげることが重要である。
・各製造所における品質向上のための自主的な点検および改善
・製造販売業者(GQP)による製造所への管理監督機能の強化
・PMDAによる調査業務の透明性確保および予見可能性の向上
【実務での活用法】
指摘事例を読むだけで終わらせてはならない。重要なのは自社のSOPや実態との乖離を確認する「ギャップ分析(Gap Analysis)」の実施である。「自社では起きていない」ではなく、「自社でも起こり得るか? その防壁はあるか?」という視点で点検を行うこと。
また、製造販売業者(GQP部門)にとっては、製造所監査を行う際の「チェックリスト」の更新材料として極めて有用である。