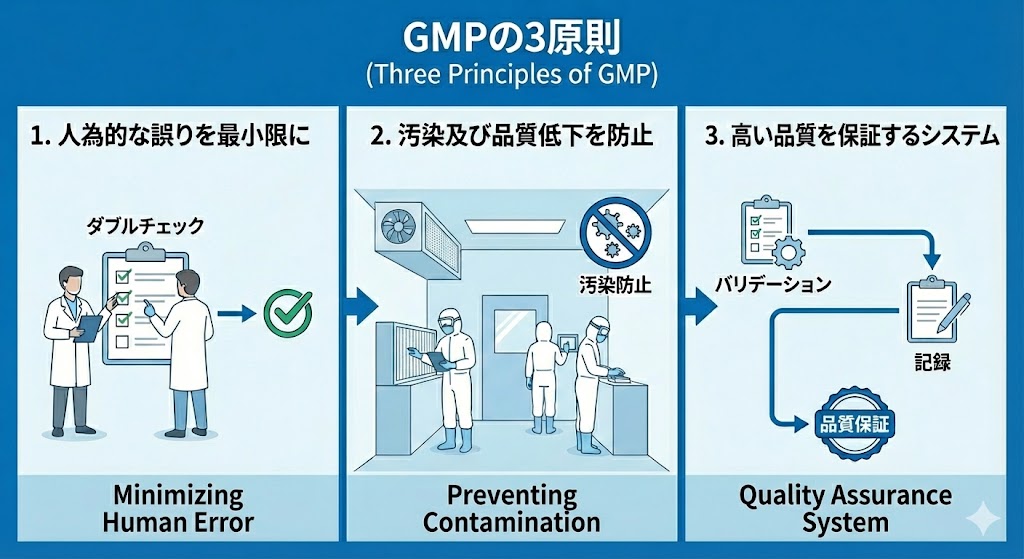
なぜGMPが必要なのか!?(ヒューマンエラーの対策)
医薬品製造においてGMPはなぜ必要なのか?
医薬品は、生命に関わる製品である。その性質上、有効性と危険性は表裏一体であり、製造における些細なミスが、患者の生命を脅かす「毒」へと変貌させるリスクを常に持っている。
このため医薬品製造の現場では、安心して使用でき、かつ期待される薬効が確実に得られるよう、徹底した安全性(Safety)・有効性(Efficacy)・品質(Quality)の管理が求められる。
しかし、製造を行うのは「人間」である。
人間にはミスをしやすいという避けられない特性があるため、法的要件であるGMP(Good Manufacturing Practice)の遵守が不可欠となるのである。
どれほど高度な設備を導入しても、それを動かすのは「人」である。
GMPでは、「人間は不完全であり、必ずエラーを犯す」という前提に基づき、そのリスクを管理しなければならない。
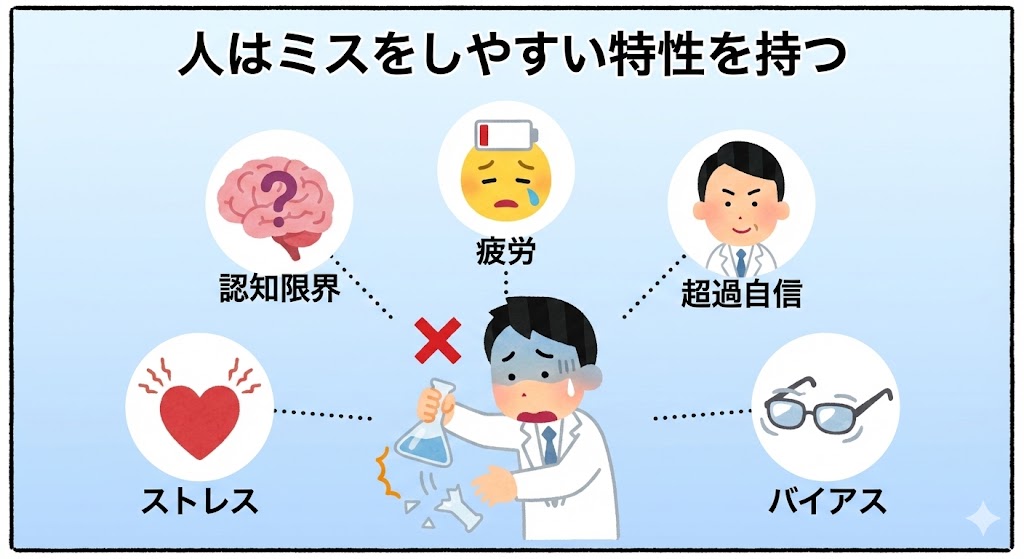
【人がミスをしやすい特性】
| 個人の能力差 | 経験年数やスキルには個人差がある。教育が不十分なまま作業に入ると、手順の意味を理解できず、異常が起きても気づけないリスクがある。 |
|---|---|
| 思い込み(バイアス) | 人は無意識に「自分は正しい」「以前もこれで大丈夫だった」と思い込む。これにより、異常の兆候を見逃したり、都合の良いように解釈したりする危険性がある。 |
| ストレスとプレッシャー | 医薬品製造特有の厳格なルールや、納期のプレッシャーは精神的負担となる。過度なストレスは判断力を鈍らせ、単純な見落としを誘発する。 |
| 自己管理の不足 | 体調不良や私生活の悩みは、集中力を著しく低下させる。自身の体調不良を隠して無理に作業することは、汚染や事故の直接的な原因となる。 |
| 慣れと慢心 | 熟練者は経験に頼り、手順書を確認せずに作業を進めてしまいがちである。「いつも大丈夫だから」という油断こそが、重大な事故の入り口となる。 |
| 生理的な限界 | 人間は長時間集中し続けることはできない。疲労や睡眠不足は、注意力の低下に直結する。 |
これらの不確実な「人の要素」をシステムで制御し、いつ誰が製造しても恒常的に一定の品質を担保することがGMPの使命である。
現場で発生する逸脱やトラブルの多くは、以下の要因に分類される。
これらは「個人の不注意」だけで片付けず、環境やルールの問題として捉える必要がある。
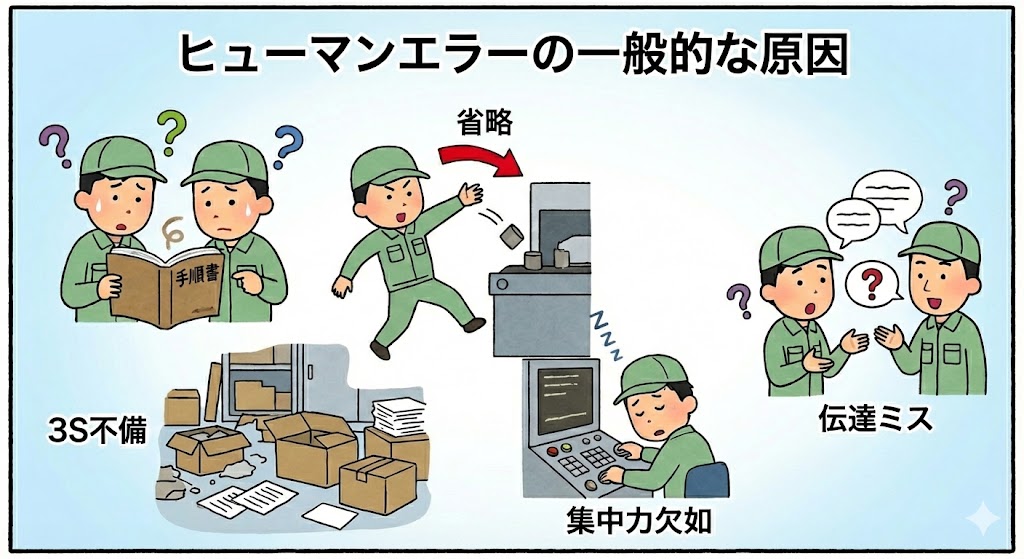
【エラーを引き起こす要因】
| 教育訓練の不足 | 新人や未経験者がよく犯すエラーである。業務に関する知識が不足しているため、誤った判断をすることがある。また、従業員が適切なトレーニングや教育を受けていない場合、製造プロセスや手順を理解していない可能性がある。エラーを減らすために、業務を繰り返し学習する必要がある。 |
|---|---|
| 勝手な手順の省略 | 「効率化」を履き違え、決められた手順を勝手に省くことは重大な違反である。ベテラン作業者による独自の「コツ」や「暗黙のルール」は、品質のバラつきを生む。 |
| 3Sの不徹底 | 整理・整頓・清掃(3S)の不備は、異物混入や製品の取り違え(ミックスアップ)の温床となる。不衛生な現場から高品質な薬は生まれない。 |
| 集中力の低下 | 単調な繰り返しの作業や、深夜勤務は脳の働きを低下させる。無意識のうちに作業を行い、記憶に残らないミスを引き起こす。 |
| 手順書の不備 | 手順書の記述が曖昧だったり、現場の実態と合っていなかったりすると、作業者は独自の解釈で動いてしまい、ミスに繋がる。 |
| 曖昧な指示・伝達 | 口頭だけの指示は、「言った・言わない」のトラブルの元である。重要事項は必ず文書や記録に残して伝える必要がある。 |
GMPでは、エラーを最小化するために「文書」と「記録」に基づく厳格な管理を求めている。
特に、国と約束した事項(承認書)を現場へ正確に落とし込むことが最重要である。
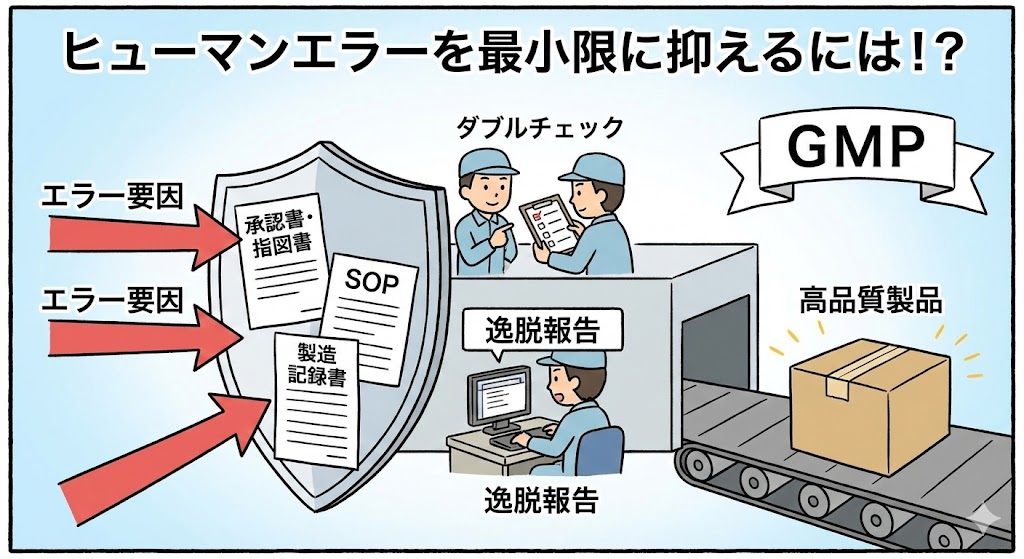
【GMPによる防止策と重要文書】
| 承認書の遵守 | 医薬品は、国に提出した「承認書(製造販売承認書)」の通りに作らなければならない。これに違反すると、法律違反となり製品回収や業務停止に至る。 |
|---|---|
| 製造指図書の厳守 | 承認書の内容に基づき発行される「製造指図書」は、製造現場における絶対的な命令書である。作業者の判断で、指図書にない操作を行うことは一切許されない。 |
| SOP(標準作業手順書) | 機械の操作方法や清掃手順などは、SOPとして文書化する。記憶に頼らず、常にSOPを手元に置いて確認しながら作業を行うことで、バラつきをなくす。 |
| 製造記録書の正確な記入 | 「製造記録書」は、正しく製造したことの唯一の証拠である。作業と同時進行で正確に記入する。記憶を頼りに後から記入することは、データの信頼性を損なう改ざん行為と見なされる。 |
| チェックリストや二重確認 | 重要な作業や手順において、チェックリストや二重確認を導入する。これにより、従業員が作業の途中で重要なステップを見落とすことを防ぎ、エラーを発見する機会を増やす。 |
| 逸脱の報告と改善 | 手順と違うこと(逸脱)が起きたら、隠さずに直ちに報告する。「誰がやったか」ではなく「なぜ起きたか」を分析し、システムを改善して再発を防ぐ。 |
ヒューマンエラー防止がもたらす価値
ヒューマンエラーの防止は、単なる規則の遵守にとどまらず、企業の社会的信用と、従業員自身の雇用・生活基盤を守るための『最大のリスク管理』である。
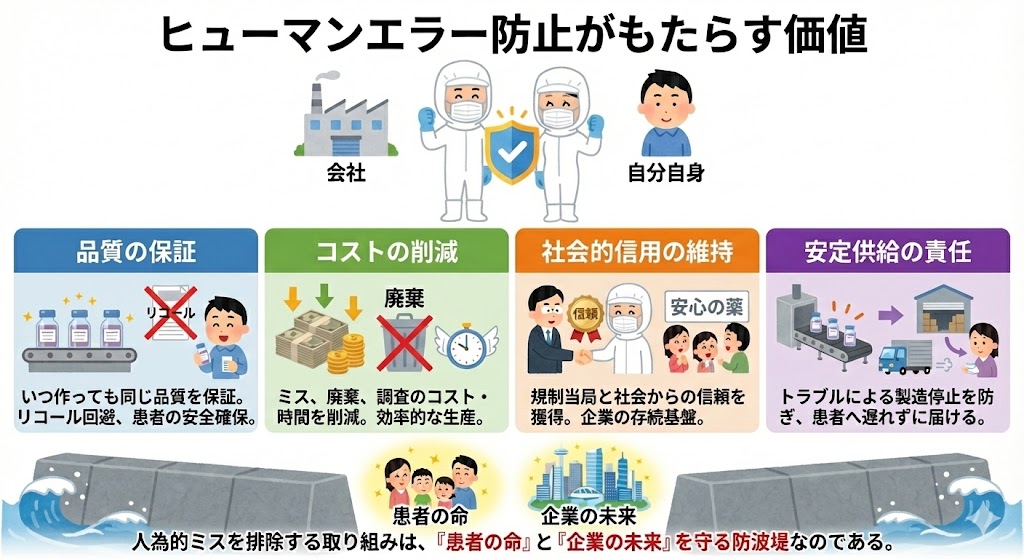
【エラー低減によるメリット】
| 品質の保証 | プロセス全体での管理により、いつ作っても同じ品質を保証する。これにより、製品回収(リコール)という最悪のリスクを回避し、患者の安全を確保する。 |
|---|---|
| コストの削減 | ミスのやり直し、廃棄、調査にかかる莫大なコストや時間を削減できる。「最初から正しく作る」ことが、結果的に最も効率が良い。 |
| 社会的信用の維持 | 厳格なGMP管理体制は、規制当局からの信頼に直結する。また、「あの会社の薬なら安心だ」という信頼は、企業の存続基盤である。 |
| 安定供給の責任 | トラブルによる製造停止を防ぎ、薬を待っている患者へ遅れることなく製品を届けることができる。 |
このように、人為的ミスを排除する取り組みは、単なる作業の一部ではなく、「患者の命」と「企業の未来」を守る防波堤なのである。
参考:GMP制定の歴史的背景
現在の厳格なGMP規制は、過去の悲惨な薬害の歴史の上に成り立っている。
1961年の「サリドマイド事件」(鎮静剤の副作用による胎児の先天異常)は、世界に衝撃を与えた。これを契機に、1962年に米国FDAが世界初のGMPを法制化し、「有効性の証明」と「製造管理」が義務付けられた。
日本では1980年にGMP省令が制定され、現在では国際基準(PIC/S GMP)と整合した、極めて厳格な管理が求められている。