PMDAと厚生労働省の違いとは!?
PMDA(独立行政法人 医薬品医療機器総合機構)とは!?
独立行政法人医薬品医療機器総合機構(PMDA:Pharmaceuticals and Medical Devices Agency)は、厚生労働省所管の独立行政法人である。
その業務は主に以下の3つから成り、これらは「セーフティトライアングル」と呼ばれ、医薬品等の全ライフサイクルを支えている。
①審査関連業務
薬機法に基づき、医薬品・医療機器などの開発から承認審査、GMP調査までを行う。
②安全対策業務
市販後の副作用情報の収集・分析、安全対策措置の検討および情報提供(添付文書の改訂指導等)を行う。
③健康被害救済業務
医薬品の副作用などによる健康被害を受けた国民に対して、医療費等の給付を行う。
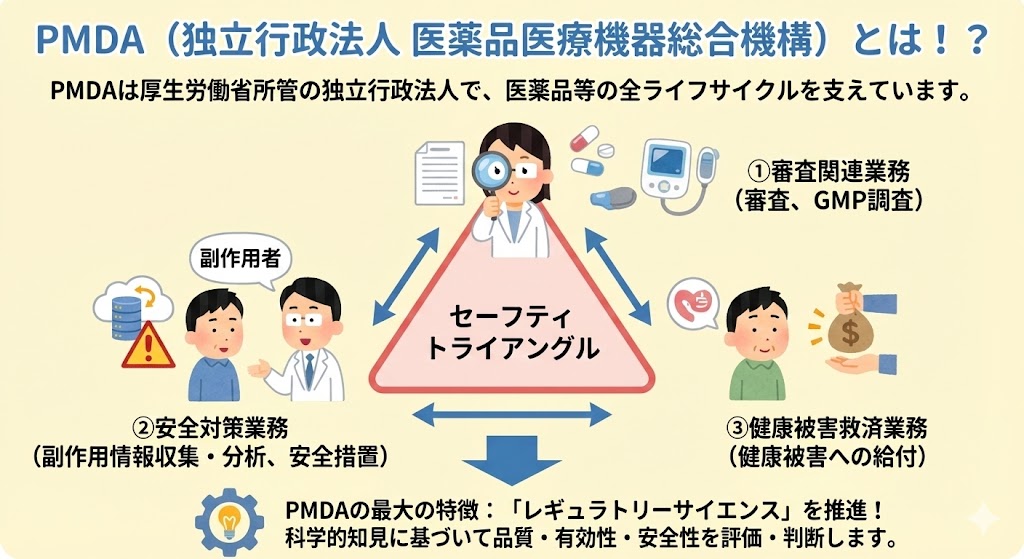
PMDAの最大の特徴は、これらの業務を通じて、医薬品・医療機器・再生医療等製品の品質・有効性・安全性を科学的知見に基づいて評価・判断する「レギュラトリーサイエンス」を推進している点にある。
厚生労働省の役割とは!?
厚生労働省は、医薬品・医療機器等行政における最終的な行政措置(処分・命令)を実施する権限を持つ。
・ 薬機法等の制度設計、法律改正(ルールの策定)
・ 薬事・食品衛生審議会への付議、および最終的な承認決裁
・ 業務停止命令、回収命令、緊急安全情報発出の指示
・ 緊急かつ重大な案件(パンデミック対応等)に係る危機管理
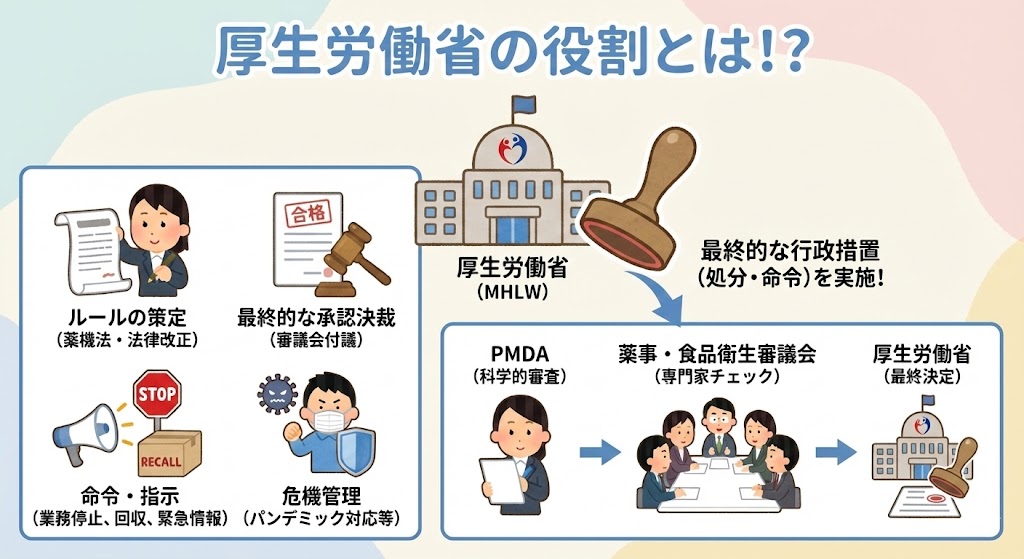
厚生労働省が承認などの行政処分を決定するにあたっては、PMDAによる科学的な審査報告書をもとに、厚生労働省に設置されている「薬事・食品衛生審議会(薬食審)」にて、第三者(専門家)によるチェックを行い、妥当性を担保している。
PMDAと厚生労働省の決定的な違い
両者の役割分担は以下のように整理できる。
PMDA・・・「科学的な評価・判断(実務・審査)」
⇒ 現場調査(実地)やデータの解析を行い、科学的根拠を積み上げる。
厚生労働省・・・「行政措置等の実施(決定・処分)」
⇒ PMDAの評価を基に、国として法的な許可や命令を下す。
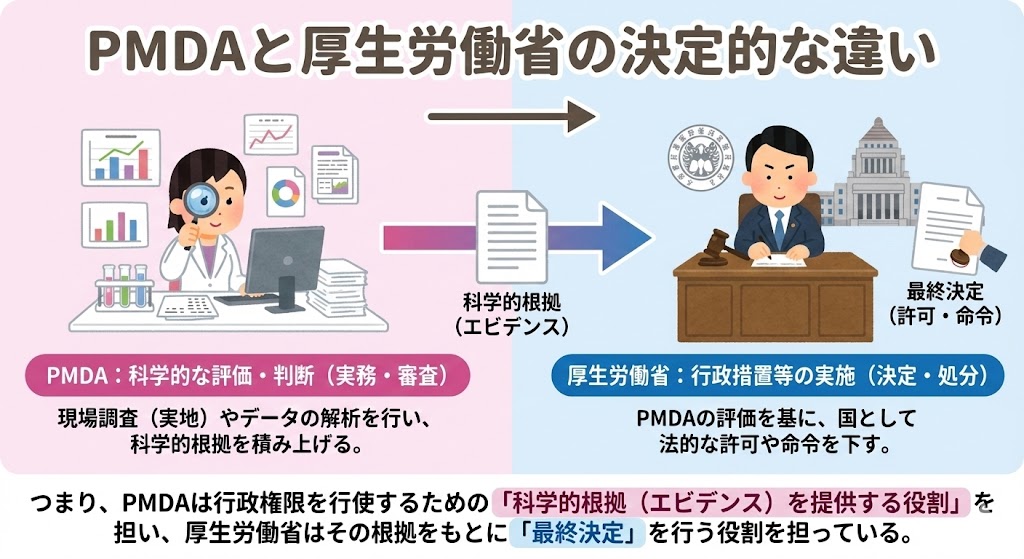
つまり、PMDAは行政権限を行使するための「科学的根拠(エビデンス)」を提供する役割を担い、厚生労働省はその根拠をもとに「最終決定」を行う役割を担っている。


