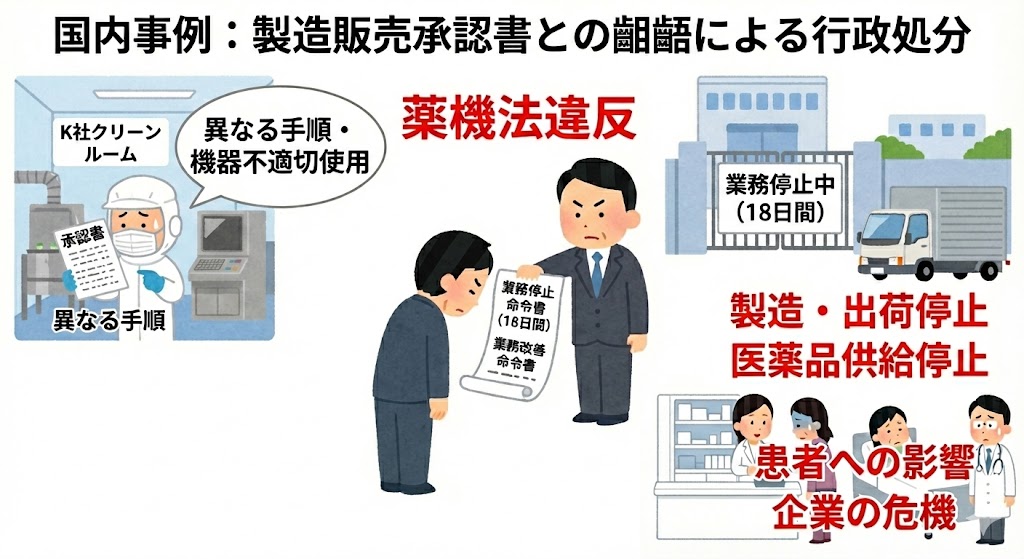
以下に、実際のGMP査察において指摘された具体的な事例を示す。これらの事例は、単なる手順の不備にとどまらず、品質システム(PQS)全体の脆弱性を示唆するものである。
安定性モニタリングに関する指摘
| 指摘内容 |
① 安定性モニタリングの不溶性異物試験において、規格不適合(OOS)となるロットが確認された。
② 当該逸脱において、不溶性異物の発生原因(根本原因)が特定されておらず、当該製品が患者に投与された際の有効性及び安全性に与える影響評価(品質リスク評価)が実施されていなかった。
③ 他ロットの参考品を調査した結果、同様に承認規格を満たさない不溶性異物が認められたにもかかわらず、各ロットに対する逸脱処理(拡大調査)が行われておらず、異物の同定や原因究明が放置されていた。
④ 当該逸脱について、速やかに製造販売業者へ連絡(報告)しておらず、情報共有の遅延により、市場への影響防止や回収等の適切な措置を講じることができない状態であった。
|
| 結論・是正対応 |
・逸脱管理、OOS処理、製造販売業者との連携といった複数の品質システムが機能不全に陥り、重大なGMP違反に至った事例である。
・個々の事象処理にとどまらず、品質システムの各要素が機能的に連携し、確実に実施される体制の再構築が不可欠である。
![医薬品製造]()
|
設備の共用と洗浄バリデーションに関する指摘
| 指摘内容 |
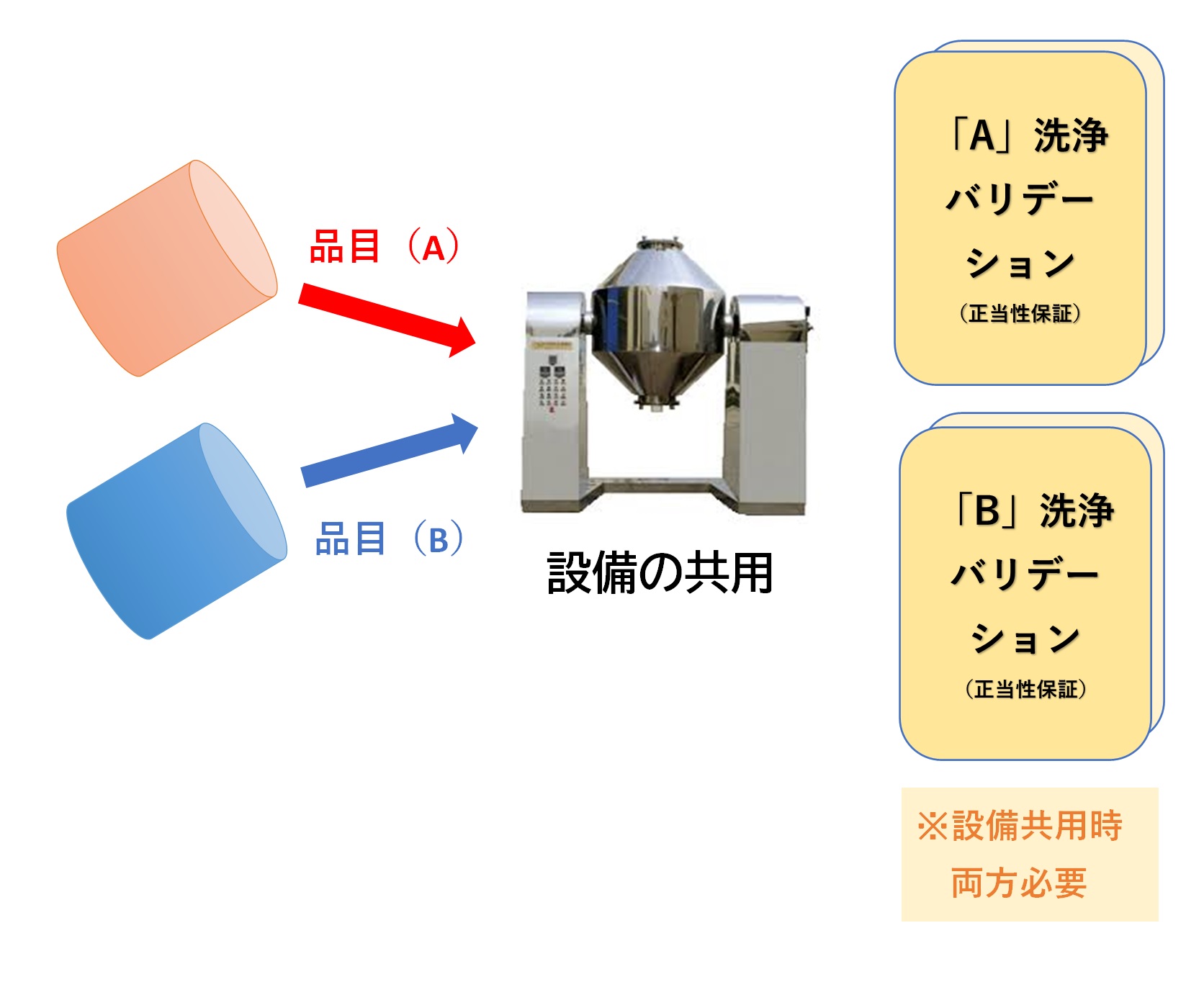
① 動物用医薬品の原薬中間体(A)の製造工程で使用しているコニカル乾燥機を、治験薬(B)の製造にも共用していた。
② 当該機器の品目切替え洗浄実施時に、スワブ法で0.003ppm以下、リンス水から約1ppmの(A)が検出されたが、許容値の科学的根拠が乏しいまま「適合」と判断し、そのまま(B)の製造に使用した。
③ そもそも(A)に対する洗浄バリデーションが実施されておらず、この洗浄方法の妥当性が不明な状態であった。
|
| 結論・是正対応 |
・多品目で設備を共用する場合、残留許容値の設定を含む洗浄バリデーション、毒性評価、交叉汚染リスクの検討が必須である。
・共用しても問題ないとする科学的妥当性を評価し、あらかじめ文書化(リスクアセスメント)しておかなければならない。
![医薬品製造]()
|
交叉汚染および現場管理に関する指摘
| 指摘内容 |
① 「注射剤用の化成品非無菌原薬」の製造設備において、現地の表示は「洗浄済み」となっており、担当者からも洗浄完了との説明があったが、査察官の現場確認により以下の通り明らかな残留物が発見された。
② 複数の製造タンク内壁に白色の残留物が付着していた。
③ 洗浄済みとされる遠心機内にジェル状の残留物が確認された。
④ 配管やバルブからの液漏れおよび結晶の析出・付着が見られた。
⑤ これらにより、洗浄工程がバリデート(保証)されていないことは明白であり、設備を共用する原薬間での交叉汚染の可能性が否定できない状態であった。
|
| 結論・是正対応 |
・GMPの基礎知識およびコンプライアンス意識(遵守意識)が著しく欠如している。
・品質を確保するためには、確立された製造・洗浄手順書(SOP)を遵守し、目視確認を徹底すること。
・年間計画に基づく定期的な教育訓練を徹底し、従業員の規範意識と「品質文化(クオリティカルチャー)」を醸成・向上させる必要がある。
![医薬品製造]()
|