医薬品製造に関わる基礎知識をまとめて紹介します。GMPとは!?医薬品をつくる工程で大切なことをまとめました。
信頼性の高い記録の要件と記録例
信頼性の高い記録の要件
バリデーション関連文書や製造・試験検査記録書はGMP文書の中核をなすものであり、適切な文書管理下において信頼性の高い記録を作成・保存することは極めて重要である。

信頼性の高い記録には、以下の要件(ALCOA+原則に準拠)が求められる。
① 記録方法およびフォーマットが標準化され、正式に承認された手順に基づいていること
② 必要な情報が網羅されていること
③ 虚偽がなく、事実に基づいた記載であること
④ 作業と同時に、正確かつ即座に記録されていること
⑤ 実施者および内容が明確であり、追跡調査(トレーサビリティ)が可能であること
⑥ セキュリティ措置により、不正アクセスや改ざんが防止されていること
⑦ 定期的な確認・監査により、不備の修正や問題(逸脱等)の解決が行われていること
記録作成にあたっては、標準作業手順書(SOP)を遵守し、情報の欠落なく、事実を正確に記載しなければならない。
また、記録者および確認者(承認者)の責任を明確にするための署名、ならびに記録の正当性を裏付けるチャートシート等の生データ(Raw Data)の添付も必須要件である。
記録は可読性が保たれている必要があり、手書き記録においては、経年劣化や改ざん防止の観点から、消去不能な筆記用具(ボールペン等)を使用するものとする。
個人を特定できる署名
「いつ作成・承認され、誰が責任を持つか」が明確であることは、正式な記録の必要条件である。
署名に関しては、確実に個人を特定できるよう、どのような筆跡や書体を用いるかをあらかじめ署名登録原簿(シグネチャーログ)等に登録しておく必要がある。
また、署名と同様にイニシャルや印鑑についても登録を行い、署名に関わる情報を一元管理しておくことが望ましい。
国際基準(グローバル)と日本の慣習の相違
日付として「19.12.01」という記載があった場合、日本国内であれば「2019年12月1日」と解釈されるのが一般的である。しかし、これは世界共通の認識ではない。
日本では「年・月・日」の順で記載することが多いが、米国では「月・日・年」、欧州では「日・月・年」が一般的である。このように表記順序が異なれば、日付の解釈に齟齬が生じるリスクがある。
したがって、各国の査察官による誤解を避けるためにも、西暦を4桁で記載するなど、日付の書式やフォーマットを統一する配慮が求められる。
また、訂正時の「取り消し線」の本数についても、日本と海外で慣習が異なる。日本では修正箇所に二重線を引くことが多いが、米国や欧州のGMPでは一本線を用いるのが一般的である。
日本の「二重線」は特殊な慣習と言えるため、日米欧3極(ICH)への対応を考慮する場合、GMP文書で使用する取り消し線は、一本線に統一すべきである。
なお、記録の訂正にあたっては、修正前の記載事項が判読できるよう一本の取り消し線を引き、正しい内容、訂正日付、訂正者の署名、および訂正理由を書き添える。
バリデーション 2025.12.01 医薬 太郎 誤記訂正
当然ながら、消しゴムや修正液・修正テープの使用は厳禁である。修正を行ったという事実そのものも、重要な記録として残さなければならないためである。
作業手順と効率を考慮した記録様式の設計
各種試験や検査項目は多岐にわたり、保存すべき測定値や判定結果のデータ量は膨大になる。
そのため、記録様式(ブランクフォーム)の設計には、作業を正確かつ効率的に行うための工夫が必要である。
例えば、以下のような様式を使用する場合を考える。
|
日付 |
実測値 |
判定 |
サイン欄 |
|---|---|---|---|
|
2019.12.01 |
9.5 |
合格 |
医薬 太郎 |
|
2019.12.01 |
9.6 |
合格 |
医薬 太郎 |
|
2019.12.01 |
9.7 |
不合格 |
医薬 太郎 |
この様式では、データごとに日付、実測値、判定、サインを都度記入しなければならない。項目が数点であれば問題ないが、数十、数百に及ぶ場合、記入ミスや抜け漏れのリスクが高まり、作業効率も低下する。
そこで、以下のように様式を改善する。
|
実測値 |
判定 |
||
|---|---|---|---|
|
9.5 |
合格・不合格 |
||
|
9.6 |
合格・不合格 |
||
|
9.7 |
合格・不合格 |
||
|
【判定基準値】合格範囲:9.4~9.6 |
|||
|
日付 |
2019.12.01 |
確認印 |
医薬 太郎 |
「合格・不合格」を選択方式(〇で囲む等)にし、サインと日付を包括的に1箇所へ記載する形式とすることで、記入の手間と転記ミスを削減できる。
また、フォーム内に判定基準値を明記しておくことは、実測値に対する判定ミスの防止に極めて有効である。
作業手順(ワークフロー)を考慮して記録フォームを作り込むことは重要である。優れたフォームは作業を効率化するだけでなく、作業者を正しい行動へと導く役割も果たす。
正確で、欠落のない記録(完全性)
記録は、後日第三者が見ても誤解が生じないよう、完全な状態で保存されなければならない。
記録用紙の空欄(未記入箇所)は、書き忘れと誤解されるのを防ぐため、斜線を引き「以下余白」や「N/A(該当なし)」等のコメントを残すことで、意図的な空欄であることを明示する。
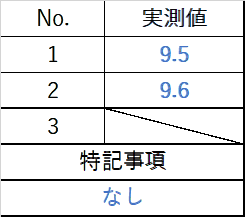
2019.12.01 医薬 太郎 斜線
また、特記事項等の欄において異常がない場合は、明確に「なし」と記入する。「特になし」という表現は、「些細な異常はあったのではないか」という曖昧さを残す可能性があるため避けるべきである。
実測値の生データ(証拠)となるチャートや写真類には、後でどの記録に紐付くデータか混乱しないよう、タイトル(管理番号)、日付、署名、必要に応じたメモ等を付記し、クロスリファレンス(相互参照)を確保する。

記録を長期間保存する過程で、添付資料が剥がれ落ちたり紛失したりするリスクがある。そのため、台紙と添付資料にまたがるように「割印(割りサイン)」や〆マーク等を施し、一体性を証明できるようにしておくことが望ましい。
さらに、長期保存においては記録の退色や変色への対策も必要である。
プロジェクトによっては原本とコピーの区別のため青色ボールペンを指定する場合もあるが、GMP規則としてインクの色に特定の規定はない。しかし、経年劣化で色あせるものや、コピー時に文字が飛んでしまうような筆記用具は使用すべきではない。
特に注意が必要なのが「感熱紙」を用いたチャート紙である。感熱紙は熱や光、経年変化により印字が消失するため、記録発生時に速やかにコピーを取り、そのコピーを原本と同等に扱うとともに、感熱紙自体も原紙として保存する運用が求められる。
たとえ原紙が色あせて判読不能になったとしても、そこに「生データが存在した」という物理的な証拠となり得るからである。