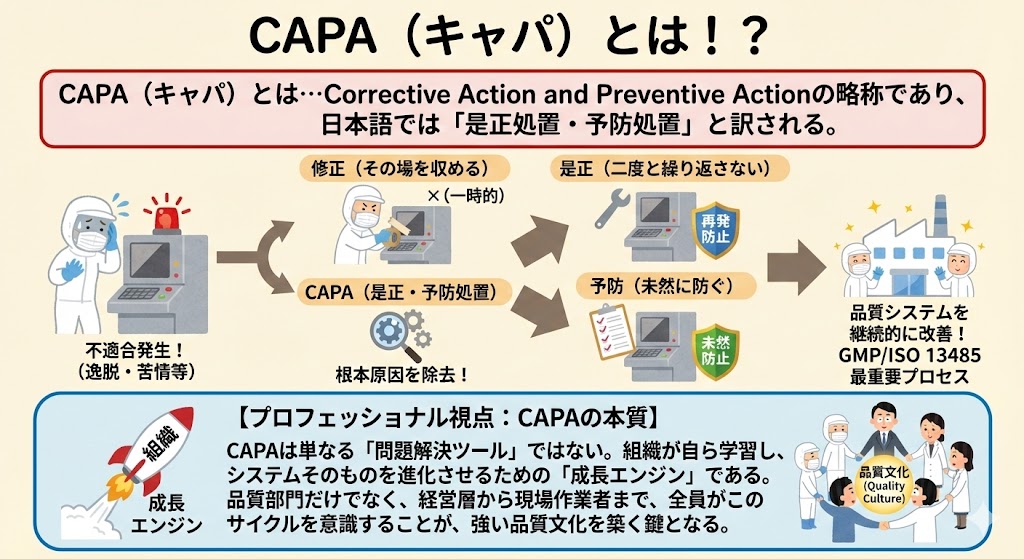
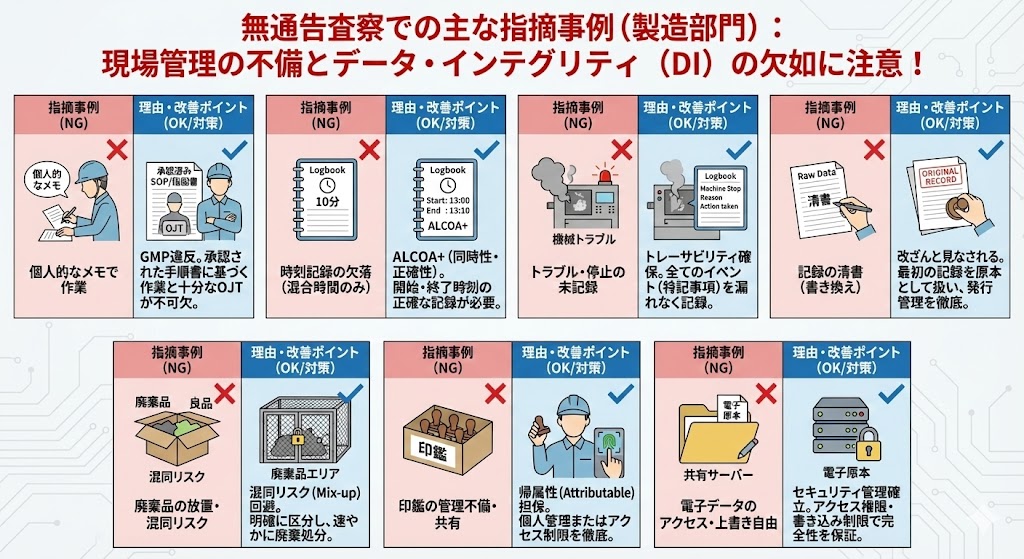
無通告査察とは!?
無通告査察とは!?
無通告査察とは、都道府県やPMDA(独立行政法人 医薬品医療機器総合機構)が、医薬品製造所等に対して、事前の連絡なく無通告(抜き打ち)で立入検査を実施することである。

かつて、原薬製造所等において、承認書と異なる方法で製造を行う、試験結果を改ざんするなどの組織的な不正行為(GMP違反)が相次いで発覚した。これを受け、従来の「事前通告あり」の査察では見抜けない「日常のありのままの製造現場」を確認するために導入された。
現在、PMDAはリスクベースのアプローチに基づき、無通告査察を常態化させている。
【査察官の狙い】
査察官が見たいのは、「きれいに掃除され、準備万端に整ったよそ行きの現場」ではない。「普段通りに手順書が守られているか」「悪い情報が隠されていないか」である。無通告査察は、企業の「品質文化(Quality Culture)」と「誠実性」を試す場であると認識すべきである。
PMDA指摘事項のトレンド
最近のGMP調査(特にPMDAによる適合性調査)では、改正GMP省令の施行(2021年8月)を受け、「承認事項と製造実態の乖離」や「データインテグリティ(DI)」、「製造販売業者と製造所の連携不足」が主要な指摘事項となっている。
査察では、手順書や記録類が単に存在するだけでなく、ALCOA+(アルコアプラス)の原則に基づき、データが正確かつ完全であることが厳しくチェックされる。
現状の手順書や記録管理について、データの完全性確保の観点からギャップ分析(リスク評価)を行い、不備があれば直ちに改善を進めることが不可欠である。
無通告査察への備え
「無通告」である以上、いつ査察官が来ても対応できるよう、日頃からのシミュレーションと体制整備が必要である。以下に具体的な準備事項を示す。
1. 受付対応の周知:PMDA職員等の突然の来訪に備え、守衛所や受付担当者に対し、入館手続きの手順(身分証確認等)を徹底しておく。
2. 連絡体制の確立:来訪時に誰に連絡し、誰が初期対応(フロント対応)を行うか、連絡網と役割分担を明確にし、守衛や受付にも共有する。
3. 査察場所の確保:査察官が待機・作業するための会議室(ベースルーム)や、インタビューを行う部屋を、速やかに確保できる体制を整える。
4. スケジュールの調整権限:査察対応を最優先とするため、製造所内で予定されていた会議や行事の中止・延期を即断できる権限を現場責任者に持たせる。
5. 他査察との重複対応:万一、海外当局(FDA等)の査察とPMDAの無通告査察が重複した場合の対応方針(どちらを優先するか、並行して対応可能か等)を事前に検討しておく。
6. 収去(サンプリング)への対応:製造品目の抜き取り調査(収去)を求められた際、速やかに検体を提供できるよう、サンプリング担当者や手順を確認しておく。(保冷剤の準備、輸送容器の確保など)
【毎日が査察日】
「査察が来たから準備する」という考え方は捨てるべきである。「毎日が査察日」という意識で、日々の逸脱処理や記録のダブルチェックを徹底することこそが、最大の無通告査察対策である。