GMP�ᔽ�������炷�d��Ȍ��ʁF��������Ɋ�Â��l�@
GMP�i���i�̐����Ǘ��y�ѕi���Ǘ��̊�j�����炵�Ȃ����Ƃ́A�P�Ȃ郋�[���̖����ɂƂǂ܂炸�A�s�������ɂ��Ɩ���~�A�����Ċ�Ƃ̎Љ�I�M�p���ĂƂ������Ԃ��̂��Ȃ����Ԃ������B�ȉ��ɁA���������ƂŎ��ۂɔ���������������ƂɁA���̌o�܂Ɖe�����������B
��������F�����̔����F���Ƃ��ꗂɂ��s������
�@2019�N�A����������K�Ђɂ����āA�R����܌������̐����ߒ��Łu�����̔����F���ɋL�ڂ��ꂽ�������@�v�Ƃ͈قȂ�菇�Ő������s���Ă������ƁA����ђ�߂�ꂽ���������@���K�Ɏg�p���Ă��Ȃ��������������o�����B
�@����ɂ��AK�Ђ͈��i��Ë@�퓙�@�i��@�@�j�ᔽ�Ƃ��āA�ΏۂƂȂ鐻�����ɑ�18���Ԃ̋Ɩ���~���߂���ыƖ����P�����Ƃ����d���s�����������B
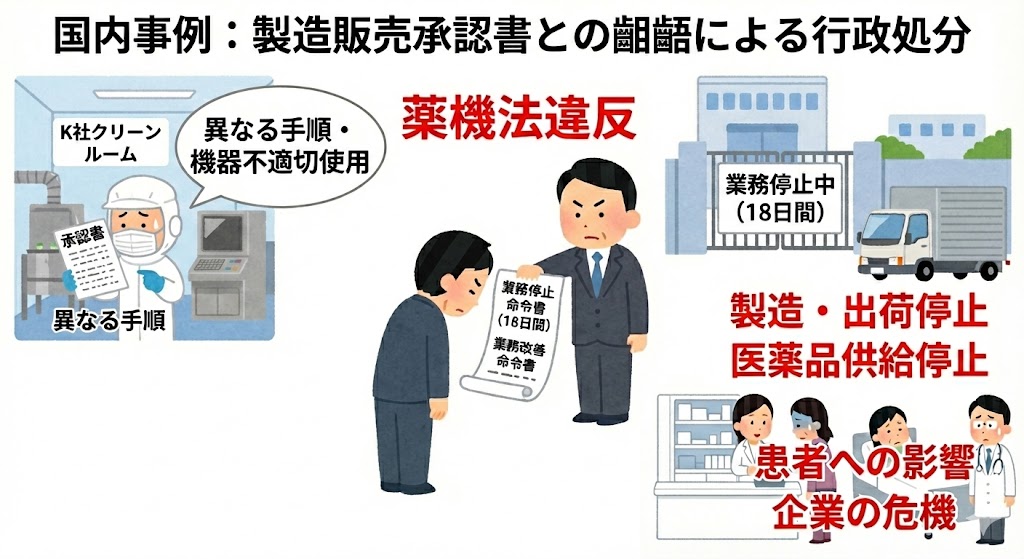
�@���̊��Ԓ��A���Y�H��ł͈�̐����E�o�Ɩ�����~���邱�ƂƂȂ�BGMP�ᔽ�́A���i�̋�����~�ɒ������A���҂̎��Ë@���D�������łȂ��A��Ƃ̑������̂��̂��낤�����郊�X�N��s��ł���B
�\���Ƃ��Ă�FDA�w�E�F�f�[�^�C���e�O���e�B�̕s��
�@�{�����s�������Ɏ��鐔�����O�AK�Ђ��č��H�i���i�ǁiFDA�j�̍��@�ɂ����Ă��d��Ȏw�E���Ă����B
�@FDA����́A���i���������͎����菇�̕s����f�[�^�C���e�O���e�B�i�f�[�^�̊��S���j�̌��@���w�E����Ă����B������_�@�ɎГ��Ő����v���Z�X�S�̂̎���_�������{�������ʁA�����̕i�ڂɂ����āu���F���̎菇�v�Ɓu���ۂ̐�������̎菇�v�ɘ����i�ꗁj������A���i�̖��ې��ۏɉe����^�����˂Ȃ����������������̂ł���B
�@K�Ђ͖�蔭�o��A����I�ɐ������ꎞ���f���A�菇�̓_���ƕi���ւ̉e���������s���ƂƂ��ɁA�Ɩ����P�ւ̎��g�݂��J�n�����B
�@�Ȃ��A���ƂȂ���������18�i�ڂɋy���A���̌��ʁA�s��ɗ��ʂ������i�ɂ��Ă͕i���E���S����̒��ړI�Ȗ��͊m�F����Ȃ������ƕ���Ă���B
�o�c�w����ъe�ӔC�҂ɋ��߂���Ӗ�
�@����̏����̎傽�闝�R�́A��@�@��14���Ɋ�Â����F���ꂽ�����i�������@���j���قȂ���@�ň��i�������i�s�������j�_�ɂ���B
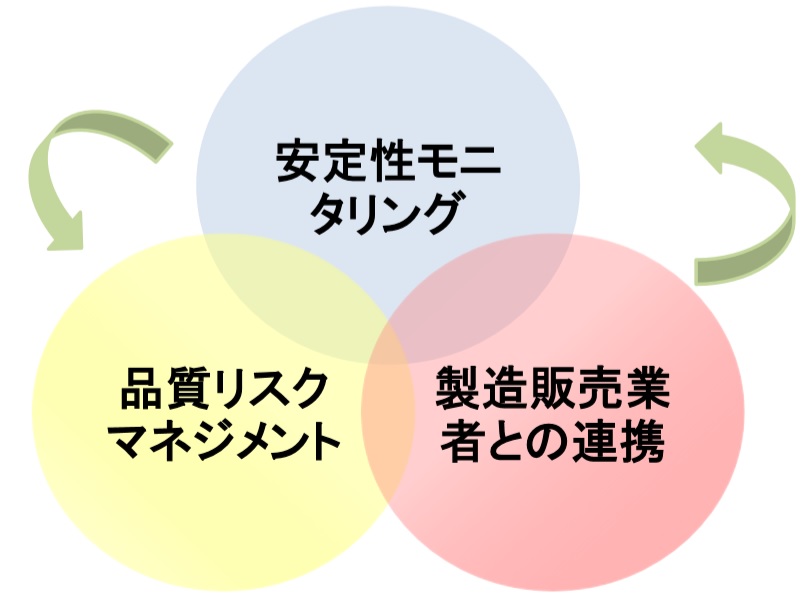
�@���ǂ�K�Ђɑ��A�ᔽ�̌��������ɉ����A��@�@�����GMP�ȗ߁A���̑��֘A�@�߂����炷�邽�߂̑g�D�̐��̔��{�I�������A����������[�u�E�\�h�[�u�iCAPA�j�̊m���Ȏ��{�𖽂����B
�@���s����苁�߂�ꂽ�����[�u����эĔ��h�~��
�@�@ �ᔽ�s�ׂɂ��āA�o�c�w�i�㋉�o�c�w�j���܂߂��e�ӔC�҂̏��݂ƐӔC�m�����邱�ƁB
�@�A ���i�����Ǘ��ҁi�H�꒷���j���A��@�@�EGMP�ȗߓ��Ɋ�Â��Ǘ��ēƖ��������I�ɍs����̐����\�z���邱�ƁB
�@�B �������储��ѕi������ɁA�K�����~���ɋƖ��𐋍s�ł���\�͂�L�����ӔC�҂�K�ɔz�u���A�Ǘ����s�킹�邱�ƁB
�@�C �����E�i���Ǘ��Ɩ��ɏ]������S�E���ɑ��A�p���I���������̂��鋳��P�������{���A�@�ߏ���i�R���v���C�A���X�j�ӎ���O�ꂳ���邱�ƁB
�u�_�u���X�^���_�[�h�v�̓P�p�ƍĔ��h�~��
�@K�Ђ͍Ĕ��h�~�Ɍ����A�O���ٌ�m���܂ޑ�O�҈ψ���ɂ�钲�������{���A���{�����̋����ɒ��͂����B
�@�����̌��ʁA�S�i�ځi��60�i�ځj��ΏۂƂ����_���ɂ����āASOP�i�W����Ǝ菇���j�Ǝ��ۂ̐������ԂƂ̊Ԃɖ�2,300�����̕s�������������ꂽ�B����ɁA���̈ꕔ�͏��F���̓��e�Ƃ��������Ă������Ƃ����炩�ƂȂ����B
�@����́A����ɂ����āu���F���i���O�j�v�Ɓu���ۂ̍�Ɓi�{���j�v�Ƃ����_�u���X�^���_�[�h����ԉ����Ă������Ƃ��������Ă���B

�@����A���Ђ�GMP����ъe��K���̏���O���}��A�o�c�w���猻���ƈ��Ɏ���܂ň�ۂƂȂ��āu�i�������i�N�I���e�B�J���`���[�j�v���č\�z���A���Ă����Љ��̐M���ɓw�߂�K�v������B