GMPとは…医薬品の製造管理及び品質管理に関する基準で、品質の良い優れた医薬品を製造するための要件をまとめた国際的な指針。 医薬品は、消費者の健康・生命に直接関わるものであるから、その品質の善し悪しはきわめて重要である。そして、どんな偶然の結果によってでも、不良品が消費者のもとに届いてはならない。 ...
【GMPの知識】関連レポート
-
-
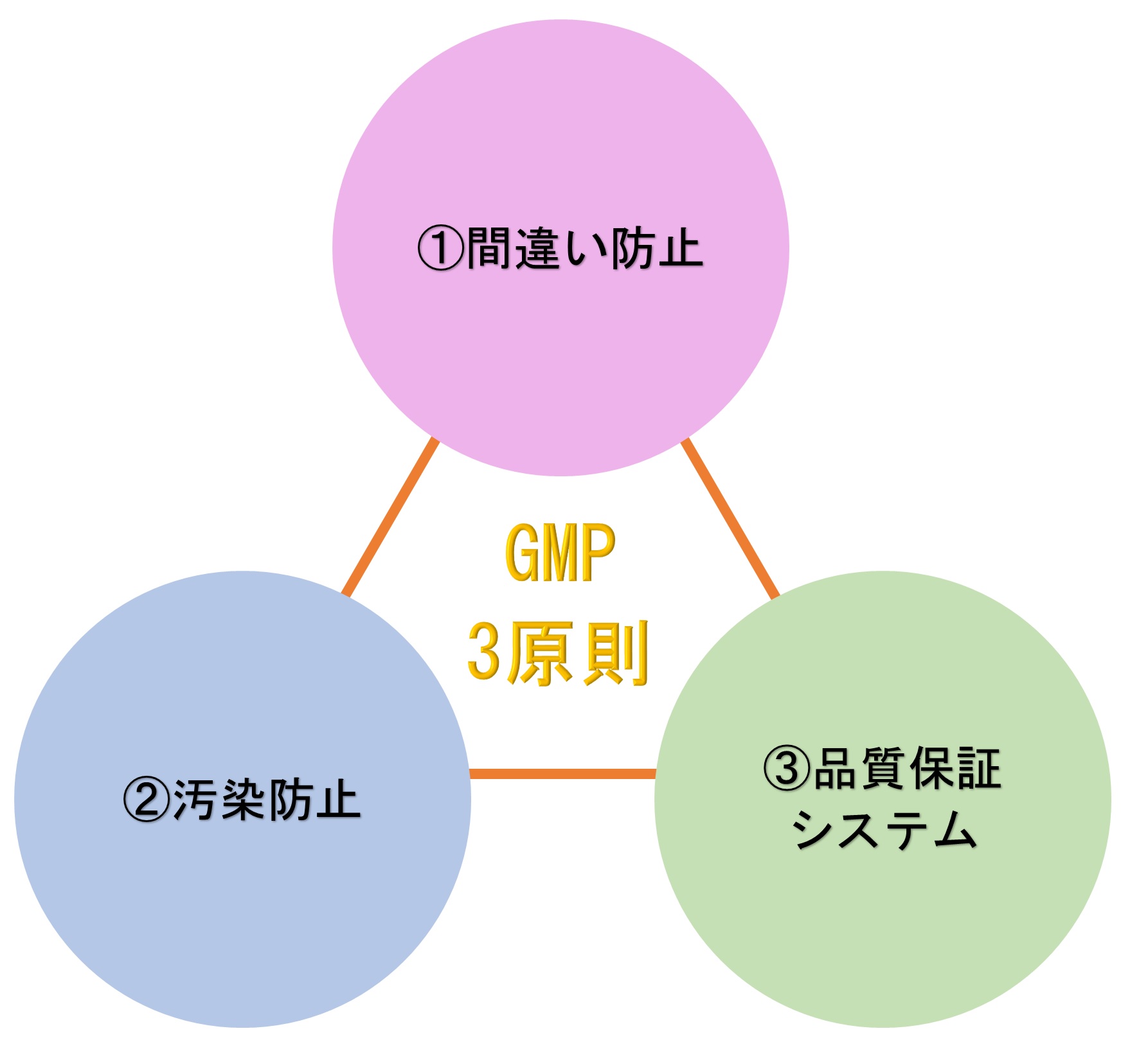
GMPの3原則とは、誰が作業しても、いつ作業しても、必ず同じ品質・高い品質の製品をつくるための基本要件である。 ①「人為的な誤りを最小限にすること」 ②「汚染及び品質低下を防止すること」 ③「高い品質を保証するシステムを設計すること」 次に、GMP3原則についてソフト面とハード面から具体的内容を示す...
-
-
医薬品製造において必ず守らなければならない管理基準であるGMPはなぜ必要なのか。 体に強く作用する医薬品は、危険な毒と紙一重である。医薬品は命を救うことができる反面、使用方法を間違えれば、命を落とす毒にもなる。 このため医薬品の製造では、安心して使用できて期待される薬効が確実に得られるような、徹底し...
-
次に、医薬品製造に関わる従業員がGMPを守るためにすべきことを示す。GMP実施に積極的に関与する 医薬品製造に関わる従業員は、GMP実施に積極的に関与しなければならない。 従業員はGMPの原則や要件を理解し、それらを実践するためのトレーニングと教育を受ける。 自身の位置、仕事、責任を自覚し、文書を読...
-
医薬品の製造に係わる業務は全てこれらの標準書・基準書及び手順書に沿って行われ、記録される必要がある。 GMPでは以下の基準や手順を文書として制定している。なぜ手順書等が必要なのか 手順書やドキュメントは、製造や検査のプロセスを明確に定義し、品質管理の基準を守るための指針を提供する。 これにより、製...
-
信用できる記録とは!? バリデーションに関する手順書や要領書、および記録書はGMP文書の一部である。このため、適切な文書を作成し、信頼性の高い記録を残すことが非常に重要である。 信用できる記録を残すには、次の点が求められる。 ①記録方法やフォーマットを標準化し承認された正式なものであること ②必要な...
-
データインテグリティとは!? データインテグリティ(Data Integrity:DI)は、「データ完全性」とも呼ばれ、米国食品医薬品局(FDA)ではデータが完全で一貫性があり正確であることと定義している。 例えば、良い試験データだけを残し、不適な試験データを削除する等のデータの不正防止または不正を...
-
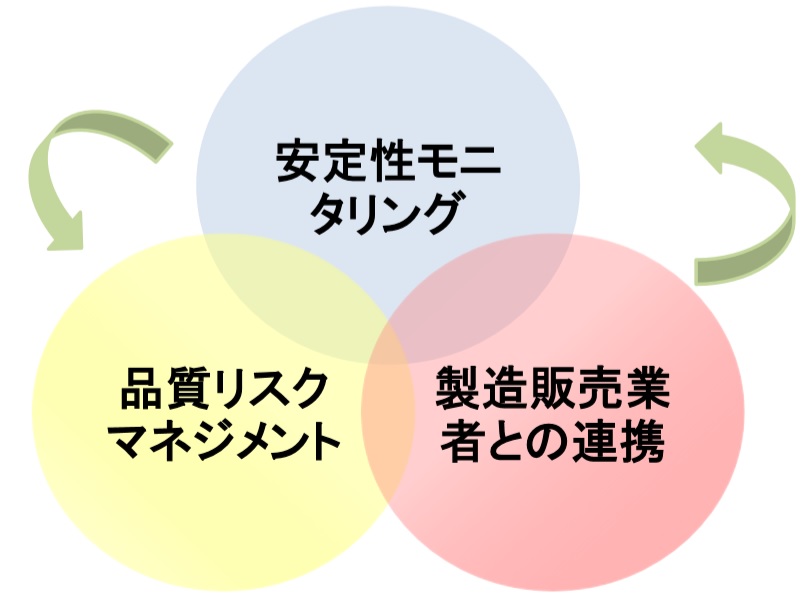
次に、GMP査察の指摘事例を示す。安定性モニタリングについての指摘事例指摘内容①安定性モニタリングにおいて、不溶性異物試験で規格不適合となったロットが確認された。②この逸脱において、不溶性異物の発生原因が特定されておらず、当該製品が患者に投与された際の有効性及び安全性に与える影響について、評価されて...
-
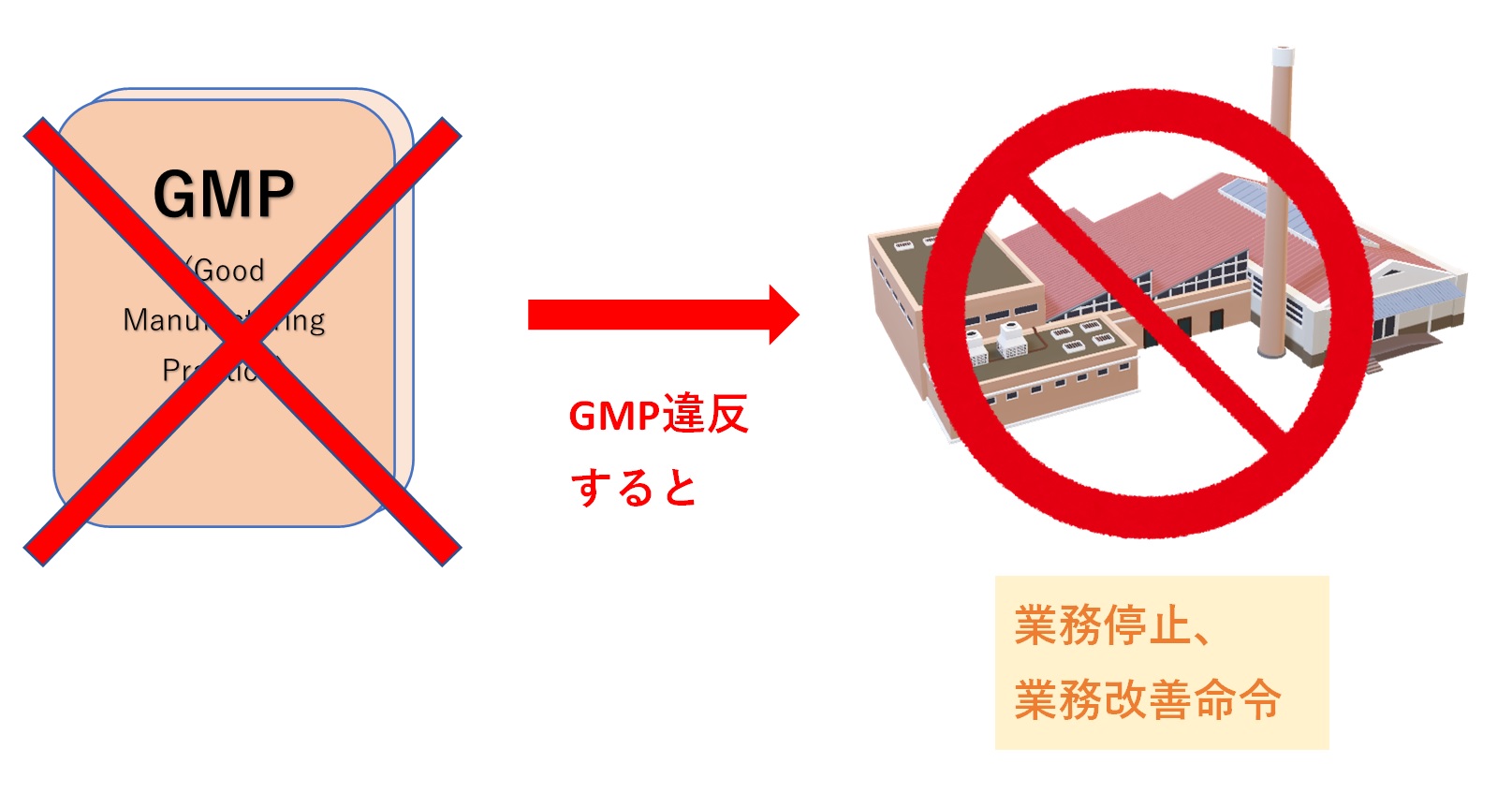
国内のGMP違反事例「抗がん剤原料の製造手順違反」 2019年、K社が抗がん剤の原料などで承認書と異なる手順を用いたことや、定められた設備や機器を正しく使用せずに製造していたことがわかった。 これによりK社は、承認時に定められた方法で製造していなかったとして、医薬品医療機器等法(薬機法)違反により、...
-
GMP指摘事例速報(オレンジレター)とは!? 独立行政法人 医薬品医療機器総合機構 医薬品品質管理部(以下「PMDA」という。)は、令和 4 年 4 月よりGMP調査における指摘事項のうち、業界への周知が特に有用と考えられる事例について、注意喚起や技術的な参考として公表することとした。 このうち、組...
-
○医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の取扱いについて(平成25年8月30日)(薬食監麻発0830第1号)(各都道府県衛生主管部(局)長あて厚生労働省医薬食品局監視指導・麻薬対策課長通知)(公印省略)医薬品及び医薬部外品の製造管理及び品質管理の基準(以下、「GMP」という。)...
-
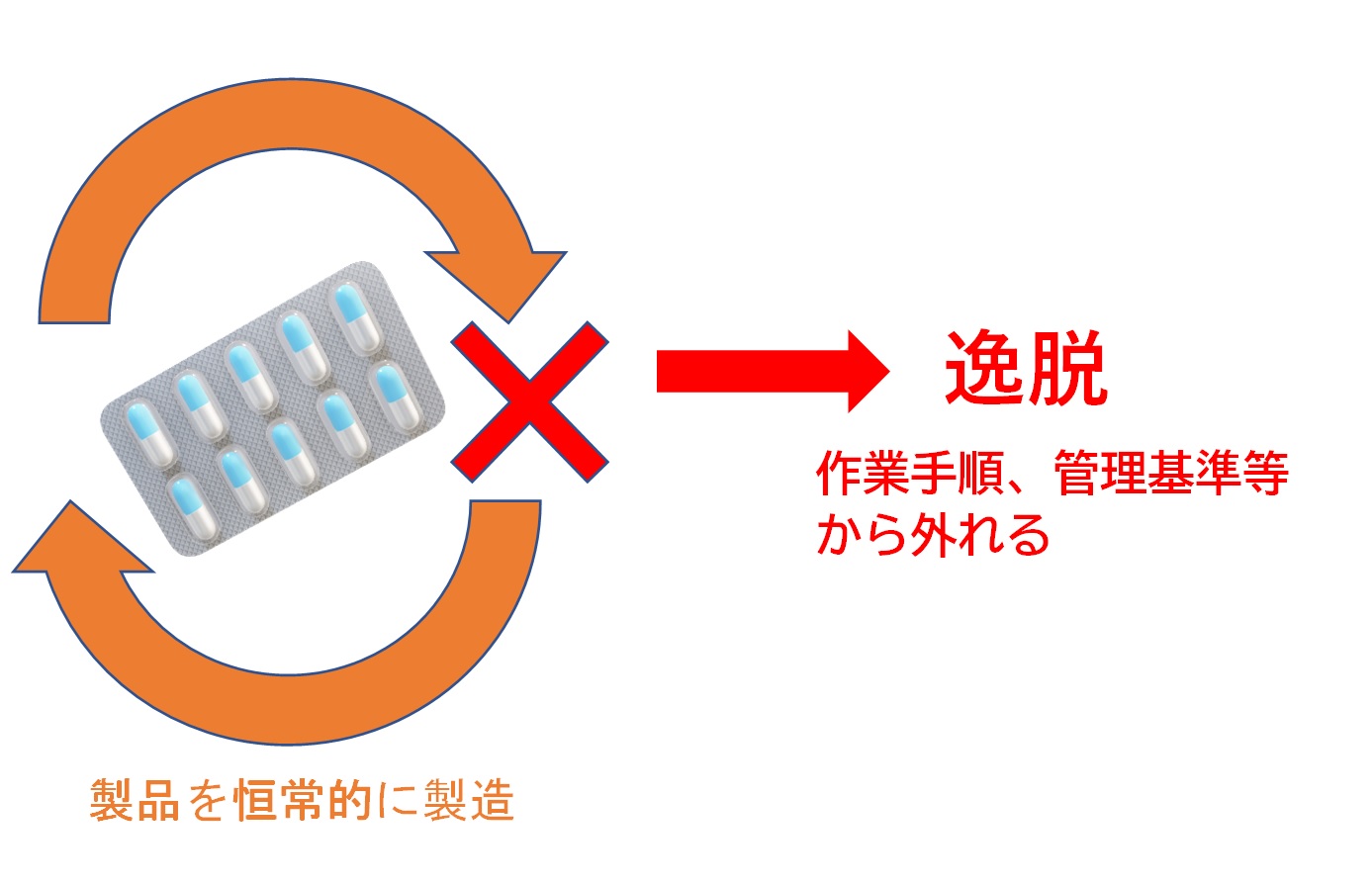
逸脱(いつだつ)とは!?逸脱(いつだつ)とは…定められた作業手順、管理基準あるいは試験規格等から乖離(かいり)している状況なり状態のこと 2005年に施行された改正GMPにより、逸脱管理が医薬品の製造に必須要件となった。 逸脱は、製造過程で起こる異常や不具合、設定された規格から外れることを指し、製品...
-
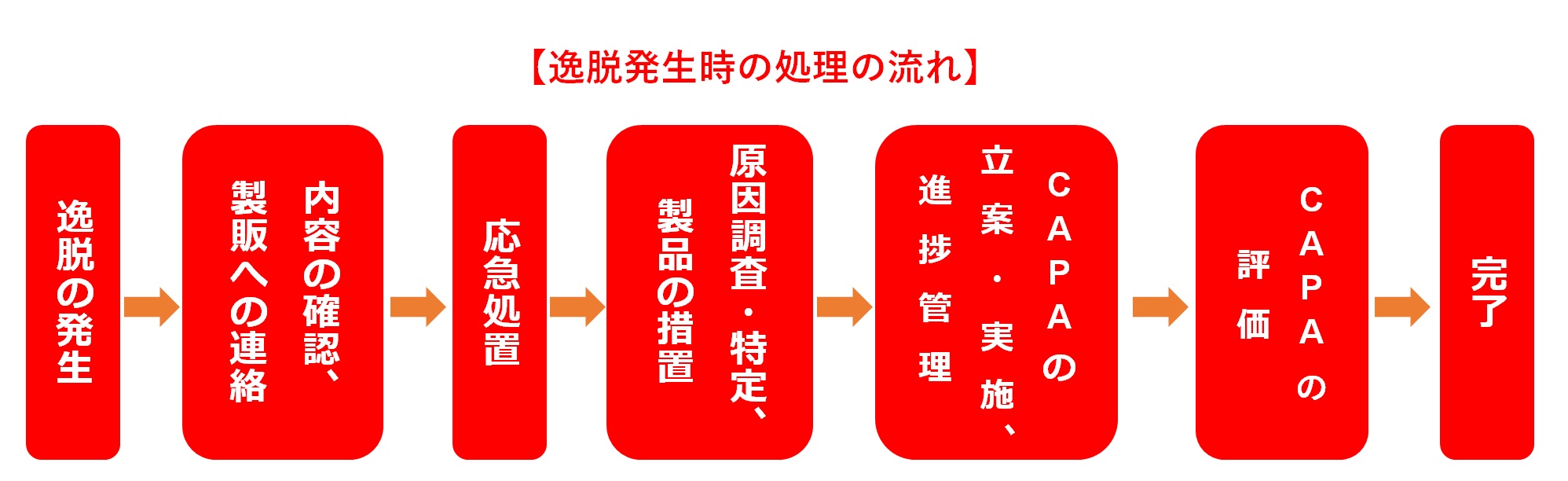
逸脱(いつだつ)発生時の対応は!? 逸脱は、さまざま原因によって発生する。次に、逸脱発生時の処理の流れを示す。 逸脱が発生すれば、応急処置を実施する以外に、製品への影響を調査して出荷の可否や回収の必要性有無を判断する。 また、直接原因や根本原因を特定し、それらに対して的確で妥当性のある是正処置/予防...
-
逸脱が発生すれば、応急処置を実施する以外に、製品への影響を調査して出荷の可否や回収の必要性有無を判断する。 また、直接原因や根本原因を特定し、それらに対して的確で妥当性のある是正処置/予防措置(CAPA)を行う。根本原因調査・特定および製品の措置 逸脱管理において原因調査は重要であり、組織としてこ...
-
-
無通告査察で医薬品の製造所等は、次のような指摘を受けている。無通告査察での指摘事例(製造)【無通告査察での指摘事例(製造)】事例1製造作業担当者が、実際の作業時に個人用メモを見て作業している。 理由作業手順書、製造記録書では、実際の作業ができないということである。作業を担当するまでのOJTが不足して...
-
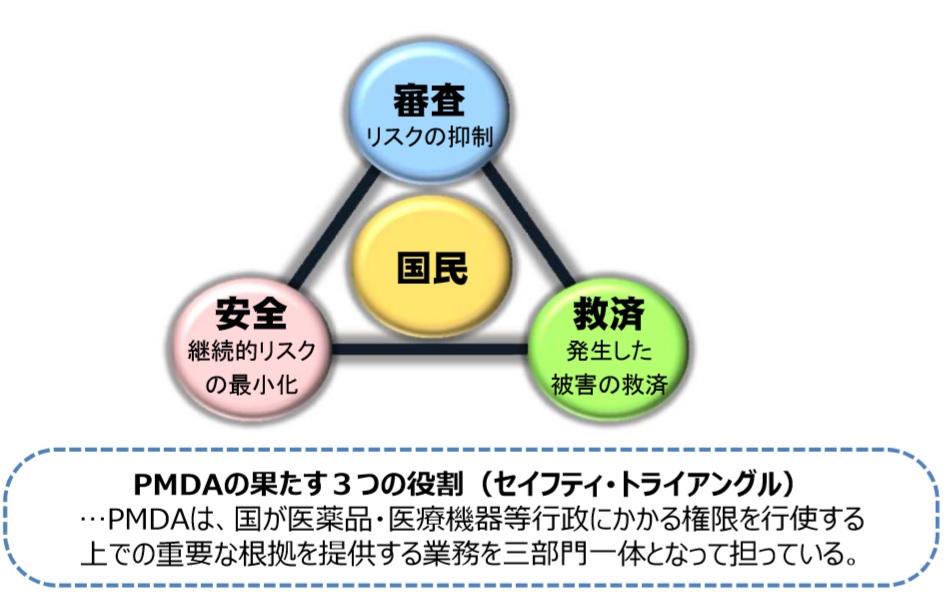
PMDAとは!? 独立行政法人医薬品医療機器総合機構「Pharmaceuticals and Medical Devices Agency」は、厚生労働省所管の独立行政法人である。 その業務には、 ①医機法に基づく医薬品・医療機器などの審査関連業務 ②医薬品の副作用などによる健康被害救済業務 ③医薬...
- トップページ
- GMPの知識