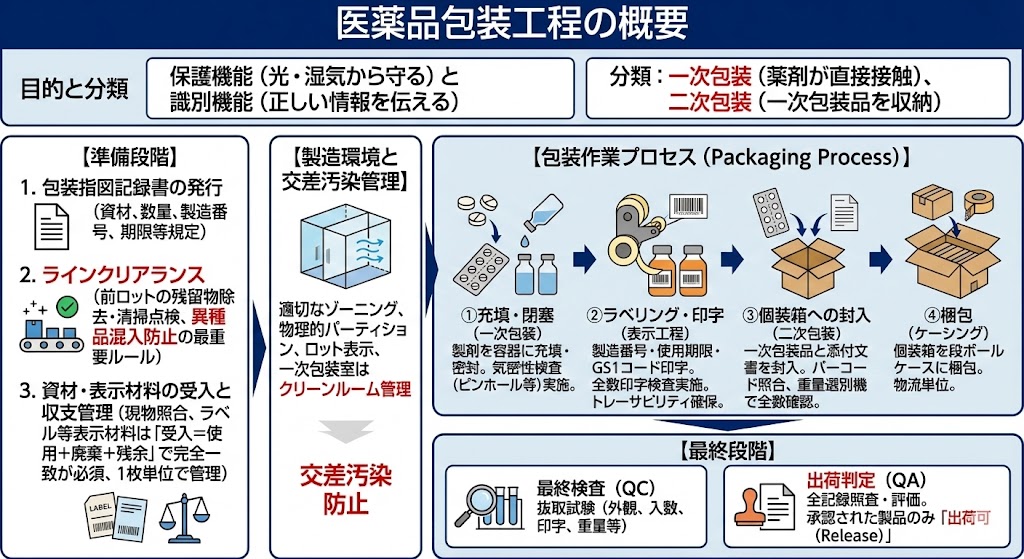
製品出荷までの流れ
製造・包装が完了した製品が、市場に出て患者の元へ届くまでの最終プロセスである「出荷」について解説する。この段階は、GMP(製造管理・品質管理基準)だけでなく、GDP(適正流通基準)が強く求められるフェーズである。
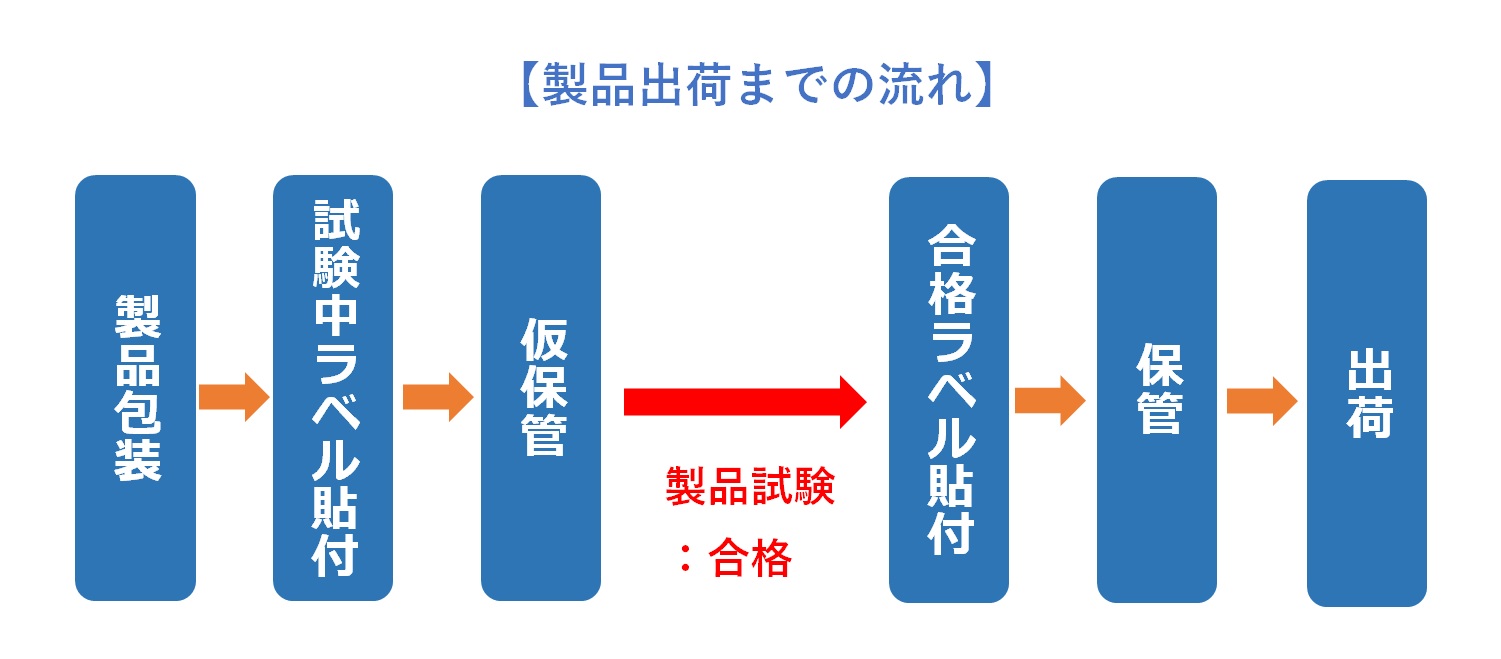
包装工程が完了した製品は、直ちに出荷できるわけではない。品質試験の結果が出るまでの間、「隔離(クアランティン)」状態で保管される。
隔離とは、試験中や判定待ちの製品が、誤って市場に出荷されないように物理的またはシステム的に分離することを指す。
物理的には、トラロープやパーティションで区画し、「試験中(黄色ラベル等)」の表示を行う。
近年の倉庫管理システムでは、コンピュータ上で在庫ステータスを「隔離(出荷停止)」に設定し、出荷指示が出せないようにロックを掛ける管理が一般的である。
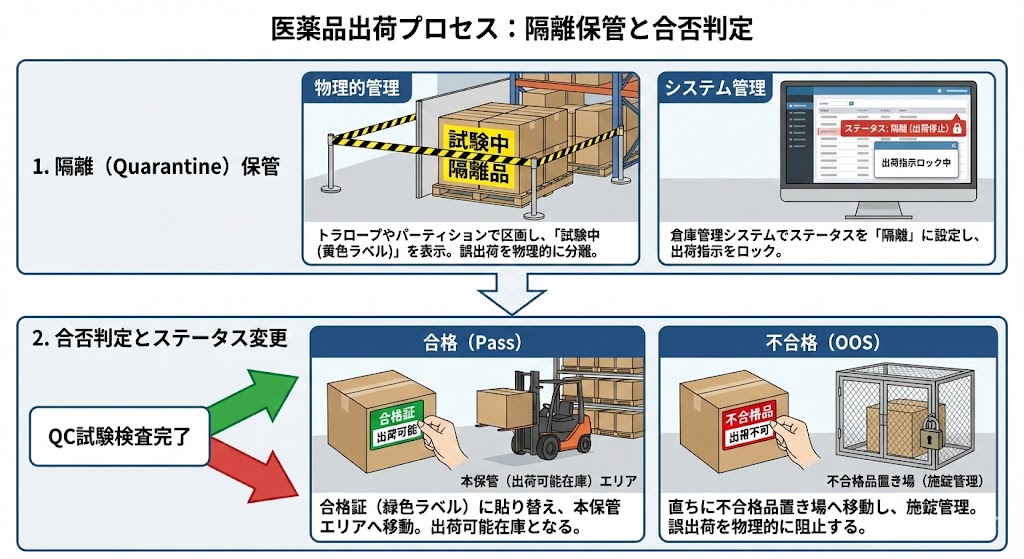
品質管理部(QC)による試験検査が完了し、合格が確認されると、製品のステータスが切り替えられる。
物理管理の場合は「合格証(緑色ラベル等)」に貼り替えて「本保管(出荷可能在庫)」エリアへ移動させる。
万が一、OOS(規格外)が発生した場合は、直ちに「不合格品置き場」へ移動させ、施錠管理するなどして、誤出荷を物理的に阻止する措置を講じる。
工場からの出荷は、予め指名された出荷判定者(品質保証責任者など)の承認なしには行えない。
QA(品質保証部)は、単に試験結果だけでなく、製造プロセス全体が適正であったかを包括的に評価する(バッチレビュー)。
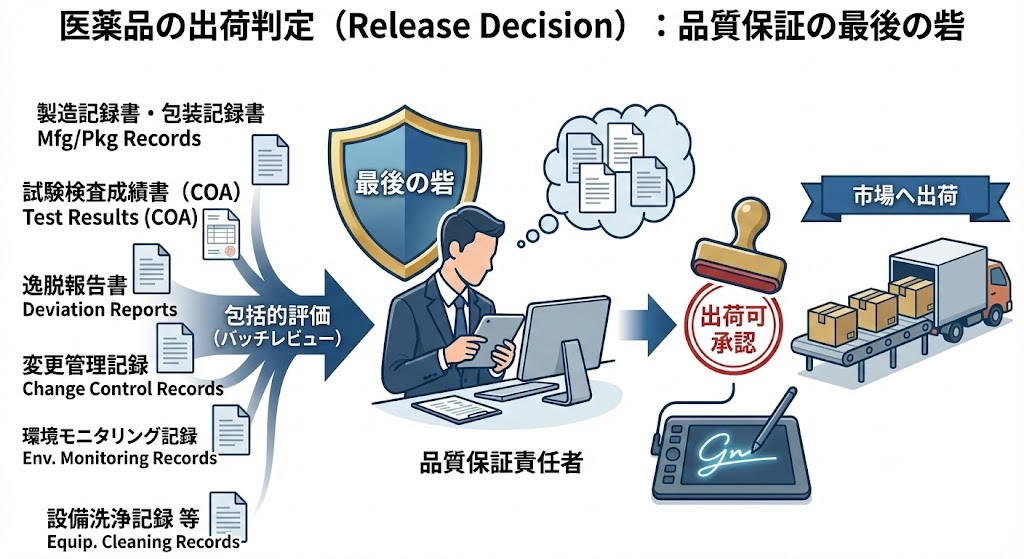
<出荷判定時に照査すべき主な記録>
・製造記録書および包装記録書(重要工程のパラメータ確認)
・試験検査成績書(COA)
・逸脱報告書(処理が完了しているか)
・変更管理記録(未承認の変更がないか)
・環境モニタリング記録(製造環境が清浄であったか)
・設備洗浄記録 等
これら全ての整合性が取れていることを確認し、出荷判定者が署名(または電子承認)を行うことで、初めて製品は「出荷可(Release)」となる。これは工場の品質保証における「最後の砦」である。
出荷待ちの製品は、品質劣化を防ぐため適切な環境で保管されなければならない。
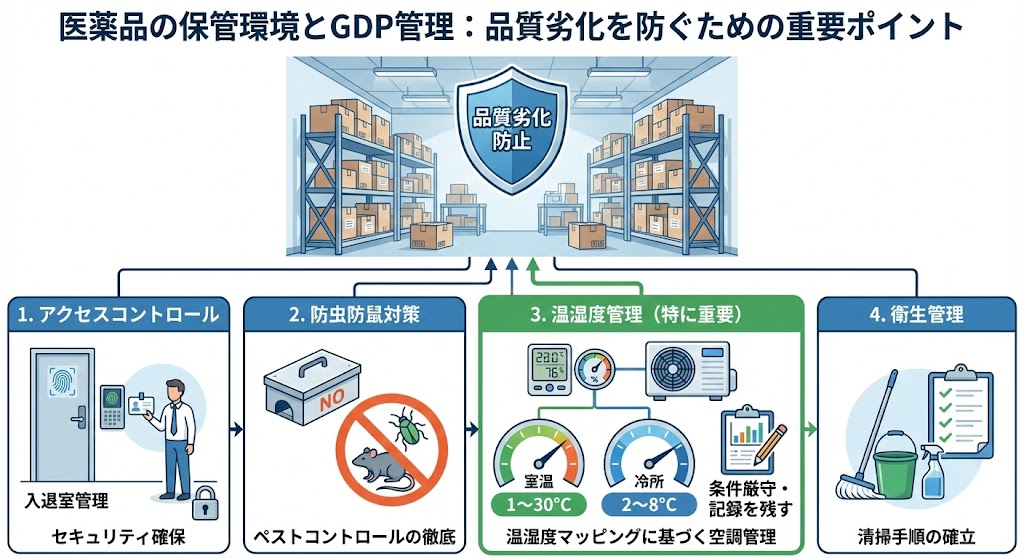
・アクセスコントロール(入退室管理によるセキュリティ確保)
・防虫防鼠対策(ペストコントロール)
・温湿度マッピングに基づく空調管理
・衛生管理(清掃手順の確立)
特に温度管理に関しては、安定性試験の結果に基づき「室温(1〜30℃)」「冷所(2〜8℃)」などの条件を厳守し、記録を残す必要がある。
出荷・保管業務を適正に行うためには、以下の文書・記録が必須となる。
特に化学物質を取り扱う場合、MSDSは現在SDS(安全データシート)に名称変更されているため注意が必要である。
<GMP/GQP関連文書>
・製品標準書
・製造管理および品質管理に関する基準書
<SOP(標準作業手順書)>
・製品入出庫および保管管理手順
・製品の識別および区分保管手順
・出荷判定手順
・輸送管理手順(配送業者の選定含む)
・返品および回収処理手順
・教育訓練手順
<記録書>
・出納管理記録(在庫台帳)
・保管庫温湿度記録
・出荷判定記録書
・教育訓練記録
<契約書・その他>
・取り決め書(配送業者、倉庫業者との品質契約)
・SDS(Safety Data Sheet:安全データシート)
出荷判定が下りた製品は、ピッキングされ、輸送トラックへ積み込まれる。
ここからはGDP(Good Distribution Practice)の領域となる。
輸送中の振動、温度変化、盗難リスクを考慮し、バリデーションされた輸送手段(保冷車や断熱ボックス等)を用いる。
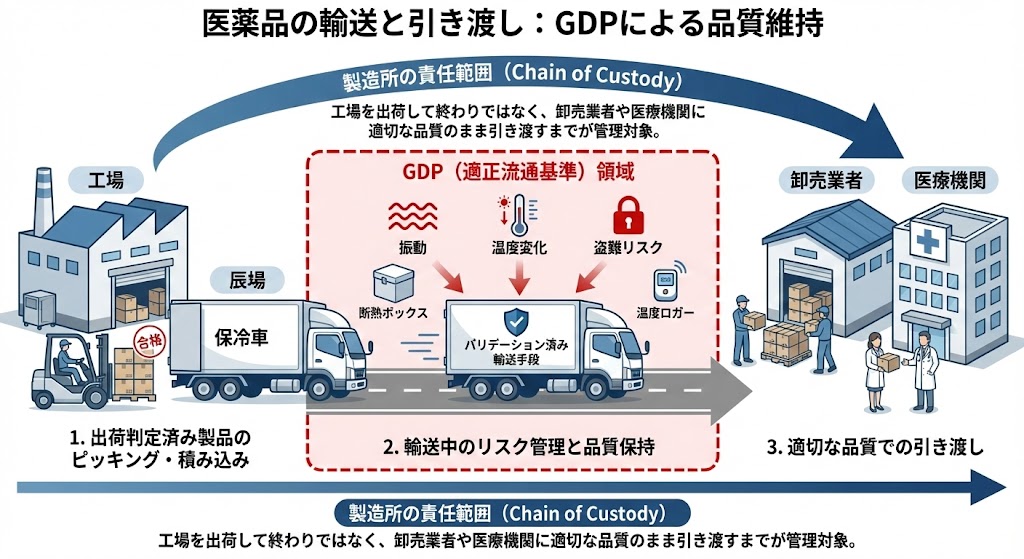
工場を出荷して終わりではなく、卸売業者や医療機関に適切な品質のまま引き渡すまでが、製造所の責任範囲(Chain of Custody)として管理される。
出荷・保管に関する主な用語解説
出荷プロセスにおける専門用語を以下に解説する。
| クアランティン (Quarantine) |
「隔離」のこと。試験中や判定待ちの製品を、合格品と混同しないよう区分して保管する状態。システム的に在庫移動を制限することも含む。 |
|---|---|
| 出荷判定者 (Authorized Person) |
製造所の品質システムに基づき、製品のロットごとに出荷の可否を最終決定する権限を持つ責任者。製造部門から独立した品質部門の人間が担う。 |
| GDP (Good Distribution Practice) |
「医薬品の適正流通基準」。製造所から出荷された後、患者の手元に届くまでの流通過程において、品質保証や偽造薬防止を確実にするための基準。 |
| SDS (Safety Data Sheet) |
「安全データシート」。化学物質の危険有害性情報や、取扱い上の注意等を記載した文書。旧来のMSDS(Material Safety Data Sheet)から名称が変更され、国際整合化されている。 |