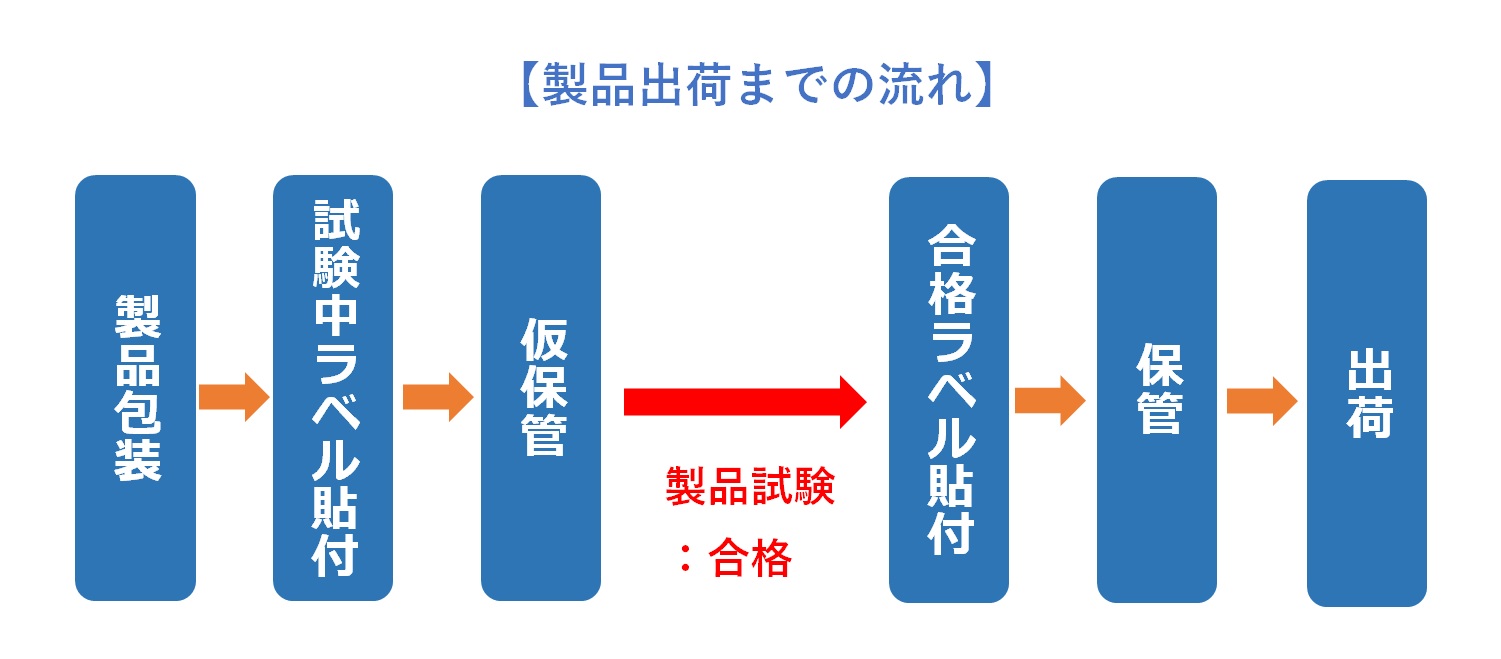
製造部門の仕事
製造部門は、製造ラインおよび関連設備の適正な操作・管理を担い、医薬品製造プロセス全体を統括する実務の中枢である。

その業務範囲は、原料の秤量・投入といった始動工程から、混合、反応、分離、精製、充填、そして最終包装に至るまで、多岐にわたる単位操作を包含する。
高品質な医薬品を安定的かつ継続的に市場へ供給するため、製造部門は以下の業務を確実に遂行する義務がある。
<製造部門の主要業務>
・製造プロセスの計画立案および工程設計の最適化
・SOP(標準作業手順書)を遵守した厳格な製造管理
・製造設備・機器の保守点検(メンテナンス)および記録の保存
・製造設備の洗浄および清浄性の保証(洗浄バリデーション等)
・計器の校正(キャリブレーション)実施および記録の管理
・製品品質、製造工程、装置に関する変更管理および影響評価
・施設および設備の適格性評価(クオリフィケーション)
・製造環境のモニタリングおよび労働安全衛生の確保
製造部門における業務の要諦は、承認・文書化された手順を厳守し、恒常的に同一品質の製品を製造することにある。
これらの業務遂行は、医薬品の安全性(Safety)、有効性(Efficacy)、品質(Quality)を担保するために不可欠なプロセスである。
承認された手順に基づき製造指図書を発行し、それに対し事実に基づいた製造記録を作成することは、GMP(製造管理及び品質管理の基準)の基本要件である。
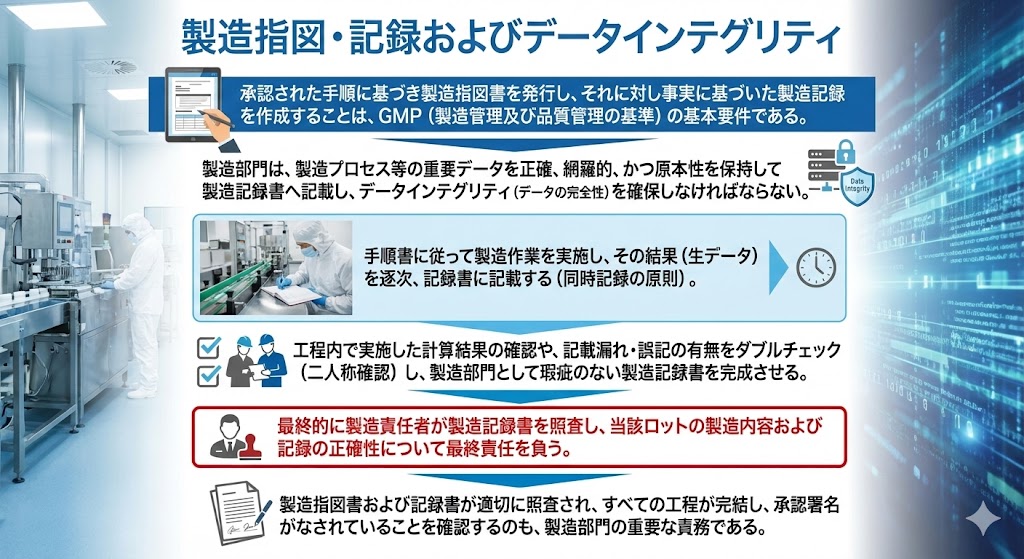
製造部門は、製造プロセス等の重要データを正確、網羅的、かつ原本性を保持して製造記録書へ記載し、データインテグリティ(データの完全性)を確保しなければならない。
手順書に従って製造作業を実施し、その結果(生データ)を逐次、記録書に記載する(同時記録の原則)。
工程内で実施した計算結果の確認や、記載漏れ・誤記の有無をダブルチェック(二人称確認)し、製造部門として瑕疵のない製造記録書を完成させる。
最終的に製造責任者が製造記録書を照査し、当該ロットの製造内容および記録の正確性について最終責任を負う。
製造指図書および記録書が適切に照査され、すべての工程が完結し、承認署名がなされていることを確認するのも、製造部門の重要な責務である。
製造責任者は、製造所における製造および衛生管理に関する業務を統括し、生産ラインが適正に稼働していることを管理監督する立場にある。

これには製造計画の策定と遂行、および製造設備の維持管理が含まれる。
その具体的な職務内容は以下の通り、極めて多岐にわたる。
<製造責任者の職務>
・製造関連文書(指図書、記録書、手順書等)の制定・改訂時の照査および承認
・ロットごとの製造指図書および製造記録書の最終照査
・製造部門が管轄する構造設備および機器の維持管理
・製造環境、原材料および製品の保管条件の管理
・製造工程における品質管理の監督
・製造衛生管理および従業員の衛生指導
・指図書、記録書、手順書の遵守状況の監視
・GMP適合状況の監視および是正措置
・プロセスバリデーションおよび再バリデーションの計画・実施・監視
・逸脱、変更、不適合、回収、返品発生時の調査および処置(CAPA等)
・原材料供給業者および製造委託先の管理監督
・製造部門職員に対する初期教育および継続的な教育訓練
製造責任者は、単に製品を製造するだけでなく、製造に関わる全ての事象の維持・改善、監視、そして人材育成(教育訓練)に対して包括的な責任を持たなければならない。
製造プロセス全体が品質基準および法的規制要件(レギュレーション)に準拠していることを常に確認し、堅牢な品質保証体系(PQS)を維持することが求められる。
主な用語解説
| 用語 | 読み方・英語 | 解説 |
|---|---|---|
| SOP | 標準作業手順書 (Standard Operating Procedures) |
誰が作業しても同じ品質の結果が得られるよう、作業の手順を具体的に定めた文書。医薬品製造における法律のようなもの。 |
| GMP | 医薬品の製造管理及び品質管理の基準 (Good Manufacturing Practice) |
安全で有効な医薬品を製造するために守るべきルール。原料の入荷から製品の出荷まで、すべての工程で品質を確保するための基準。 |
| バリデーション | Validation | 製造所の設備や手順が、期待される結果を恒常的に生み出すことを科学的に検証し、文書化すること。「妥当性確認」とも訳される。 |
| キャリブレーション | Calibration | 計測機器(秤、温度計など)が正しい値を示しているかを確認し、必要に応じて調整すること。「校正」とも言う。 |
| データインテグリティ | Data Integrity | 「データの完全性」。データが完全で、一貫性があり、正確であること。書き換えや改ざんがされていないことを保証する概念。 |
| 適格性評価 | Qualification | 設備や機器が、設計通りに設置され、意図した通りに動作することを確認・記録するプロセス。(IQ, OQ, PQなどが含まれる) |
| 逸脱 | Deviation | 製造手順や基準から外れてしまった事象のこと。発生した場合は直ちに報告し、製品品質への影響を調査する必要がある。 |
| CAPA | 是正予防措置 (Corrective and Preventive Action) |
発生した不適合(ミスやトラブル)の原因を根本から絶つ「是正」と、将来起こりうる問題を未然に防ぐ「予防」の一連の活動。 |
| PQS | 医薬品品質システム (Pharmaceutical Quality System) |
経営陣の責任のもと、医薬品の全ライフサイクルを通じて品質を維持・改善していくための統合的なシステム(ICH Q10)。 |