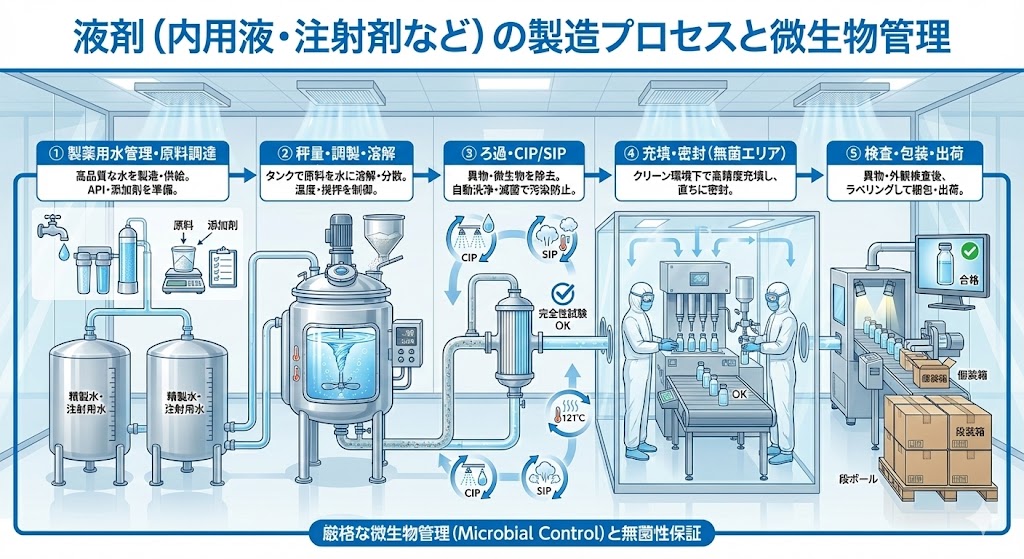
バイオ医薬品製造の流れ
従来の医薬品(低分子医薬品)は、化学反応を組み合わせる「化学合成」によって製造され、分子構造が明確で小さいことが特徴である。
対してバイオ医薬品は、遺伝子組換え技術や細胞培養技術などのバイオテクノロジーを応用し、微生物や動物細胞の「生体機能」を利用して製造される。分子量が大きく、構造が極めて複雑であるため、製造プロセスの管理が品質に直結する。
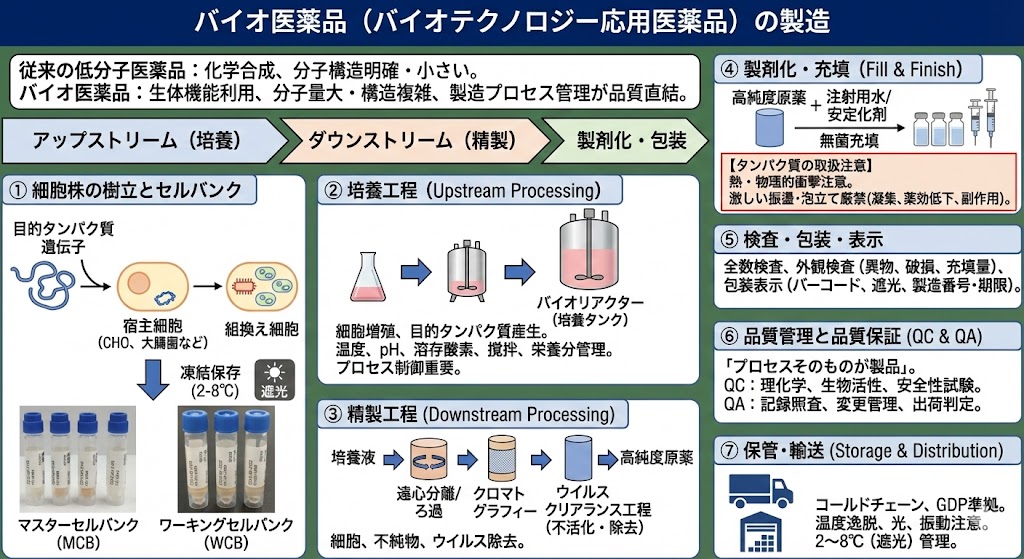
バイオ医薬品の製造は、一般的に「アップストリーム(培養)」、「ダウンストリーム(精製)」、「製剤化・包装」、そして全体を統括する「品質保証」からなる。
細胞株の樹立とセルバンクの作製
目的とするタンパク質の遺伝子情報を、宿主(ホスト)となる細胞(CHO細胞などの動物細胞、大腸菌、酵母など)に導入し、医薬品を産生する能力を持った「組換え細胞」を作製する。
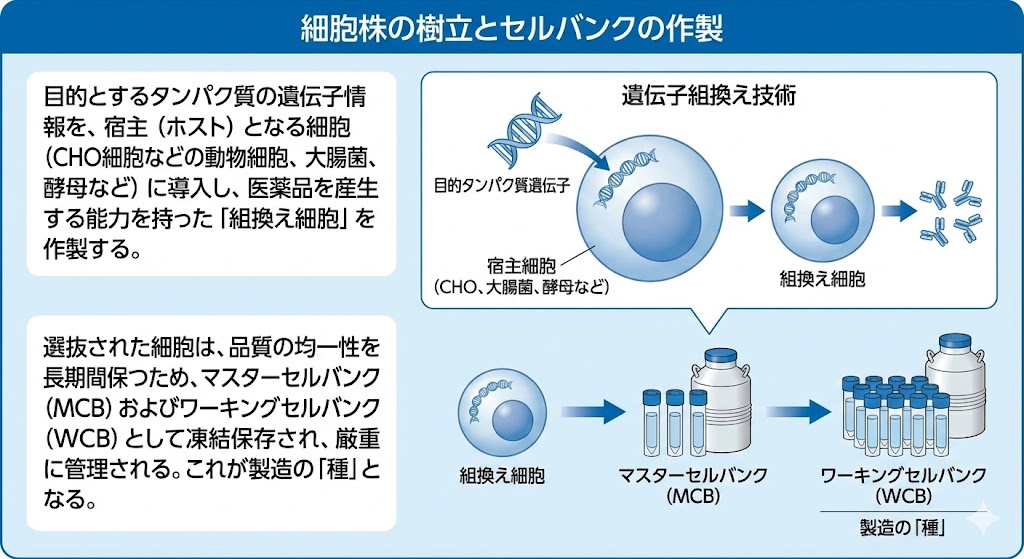
選抜された細胞は、品質の均一性を長期間保つため、マスターセルバンク(MCB)およびワーキングセルバンク(WCB)として凍結保存され、厳重に管理される。これが製造の「種」となる。
培養工程(Upstream Processing)
「培養工程」では、細胞を段階的に増やし、最終的に数千〜2万リットル規模の巨大な培養タンク(バイオリアクター)で増殖させ、目的のタンパク質を作らせる。
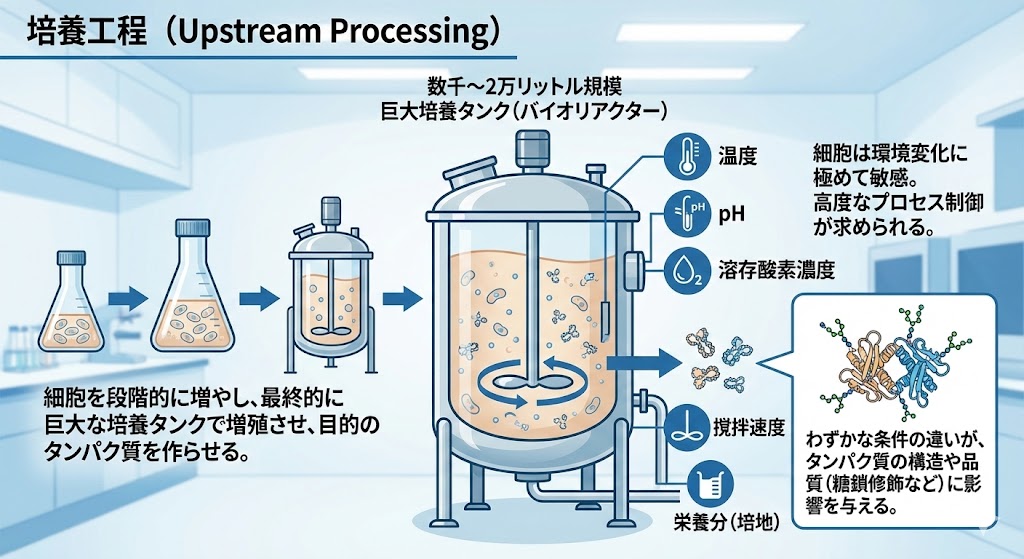
細胞は生き物であるため、温度、pH、溶存酸素濃度、撹拌速度、栄養分(培地)などの環境変化に極めて敏感である。
わずかな条件の違いが、タンパク質の構造や品質(糖鎖修飾など)に影響を与えるため、高度なプロセス制御が求められる。
精製工程(Downstream Processing)
「精製工程」は、培養液から細胞や不純物を取り除き、目的のタンパク質のみを高純度に取り出す作業である。
遠心分離、ろ過、および複数のクロマトグラフィー(アフィニティ、イオン交換など)を組み合わせる。
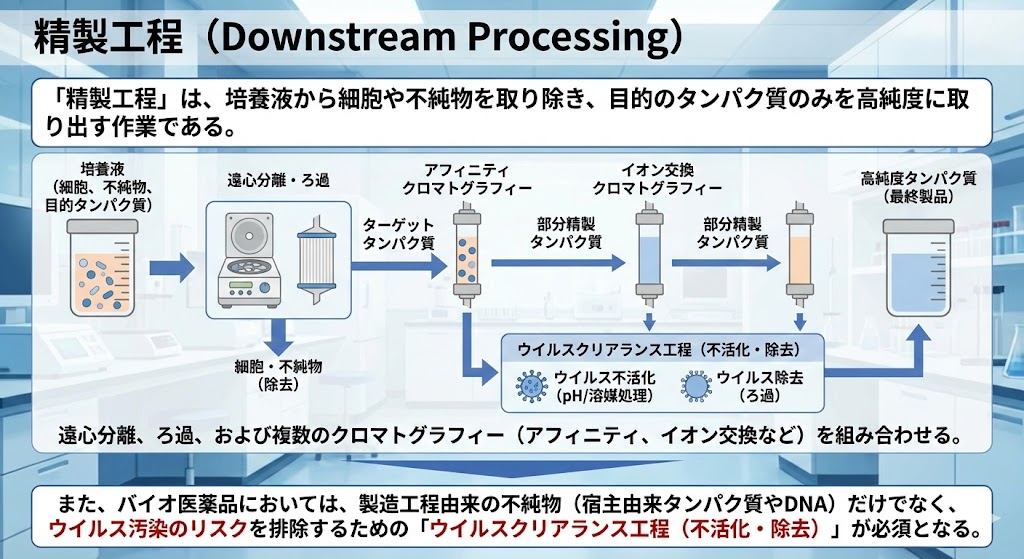
また、バイオ医薬品においては、製造工程由来の不純物(宿主由来タンパク質やDNA)だけでなく、ウイルス汚染のリスクを排除するための「ウイルスクリアランス工程(不活化・除去)」が必須となる。
製剤化・充填(Fill & Finish)
精製された高純度な原薬を、注射用水や安定化剤と調合し、バイアル(ガラス瓶)やシリンジ(注射器)に無菌充填する。
バイオ医薬品は主に注射剤であるため、無菌性の保証が最優先事項となる。
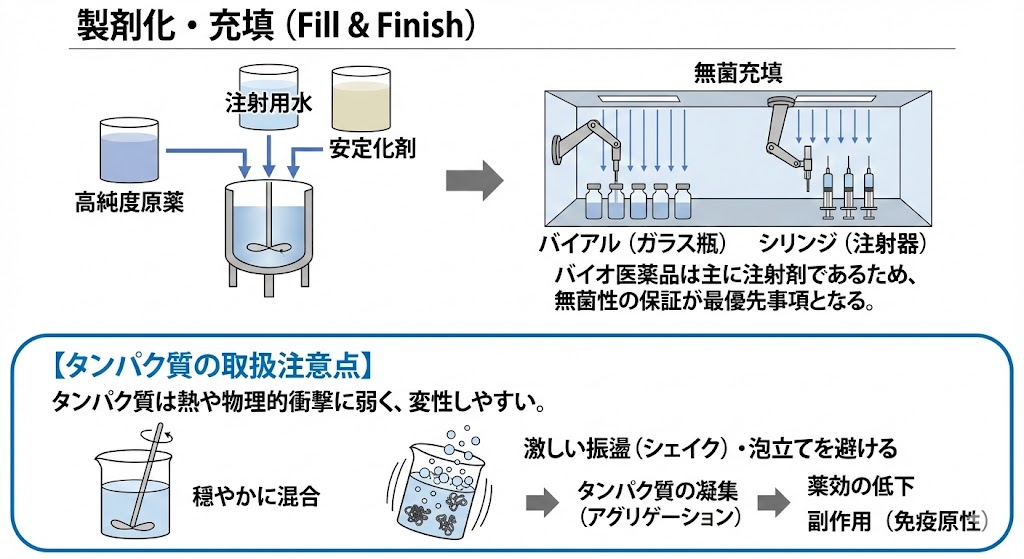
【タンパク質の取扱注意点】
タンパク質は熱や物理的衝撃に弱く、変性しやすい。
製造現場や医療現場での調製時(溶解時)には、激しい振盪(シェイク)や泡立てを避け、穏やかに混合する必要がある。激しい撹拌はタンパク質の凝集(アグリゲーション)を招き、薬効の低下や副作用(免疫原性)の原因となる。
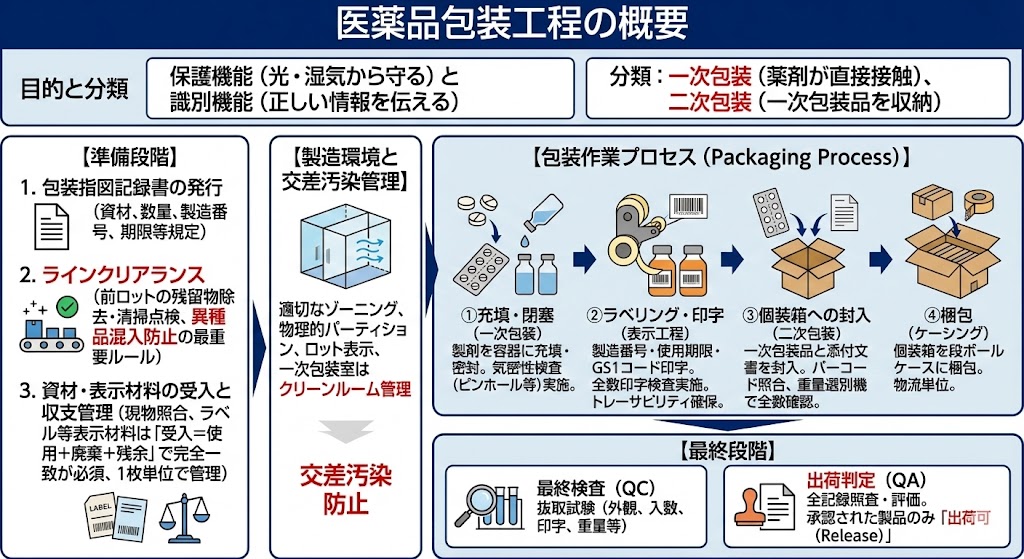
充填された製品は、1本ずつ厳密な検査を経て、市場に出る姿へと仕上げられる。
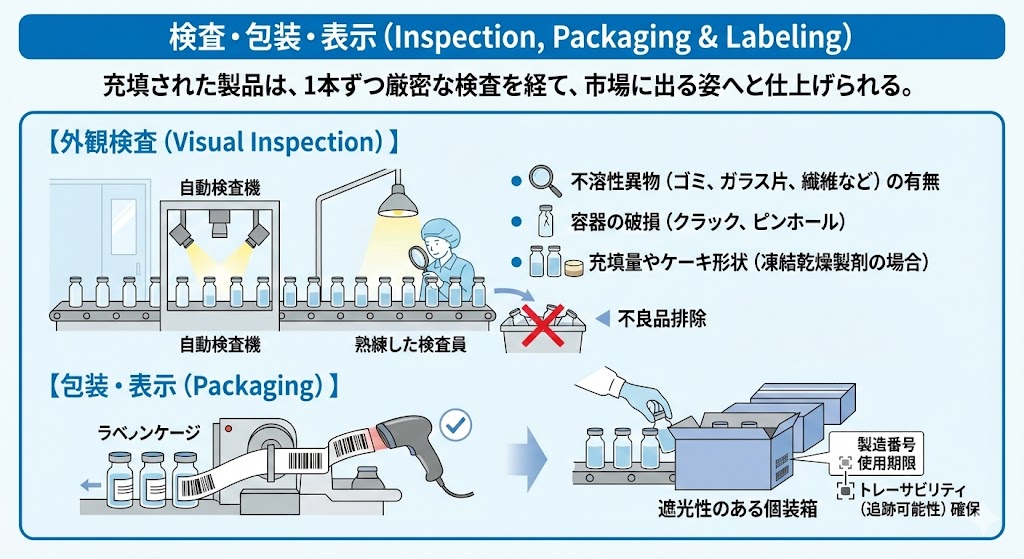
【外観検査(Visual Inspection)】
高精度の自動検査機および熟練した検査員により、全数検査が行われる。
・不溶性異物(ゴミ、ガラス片、繊維など)の有無
・容器の破損(クラック、ピンホール)
・充填量やケーキ形状(凍結乾燥製剤の場合)
これらを厳しくチェックし、不良品を確実に排除する。
【包装・表示(Packaging)】
ラベルの貼り間違い(表示ミス)は重大な医療事故につながるため、バーコード等で厳重に照合される。
多くのバイオ医薬品は光に弱いため、遮光性のある個装箱に梱包される。また、トレーサビリティ(追跡可能性)確保のため、個々の製品には固有の製造番号や使用期限が印字される。
バイオ医薬品は「プロセスそのものが製品である(The Process is the Product)」と言われる通り、最終製品の試験だけでなく、プロセス全体の管理が品質を決定づける。
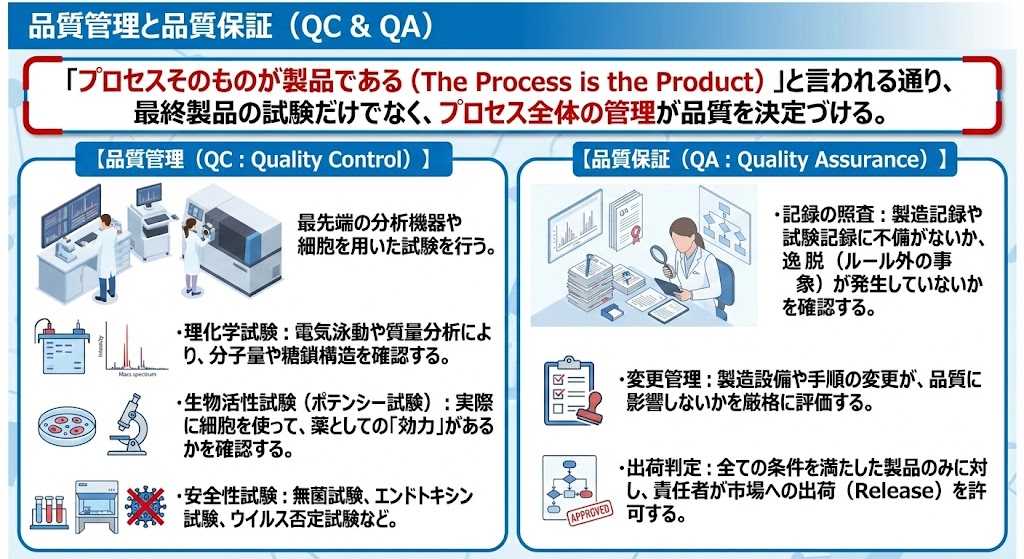
【品質管理(QC:Quality Control)】
最先端の分析機器や細胞を用いた試験を行う。
・理化学試験:電気泳動や質量分析により、分子量や糖鎖構造を確認する。
・生物活性試験(ポテンシー試験):実際に細胞を使って、薬としての「効力」があるかを確認する。
・安全性試験:無菌試験、エンドトキシン試験、ウイルス否定試験など。
【品質保証(QA:Quality Assurance)】
・記録の照査:製造記録や試験記録に不備がないか、逸脱(ルール外の事象)が発生していないかを確認する。
・変更管理:製造設備や手順の変更が、品質に影響しないかを厳格に評価する。
・出荷判定:全ての条件を満たした製品のみに対し、責任者が市場への出荷(Release)を許可する。
工場から医療機関、そして患者の手に渡るまで、一貫した温度管理(コールドチェーン)が必須である。
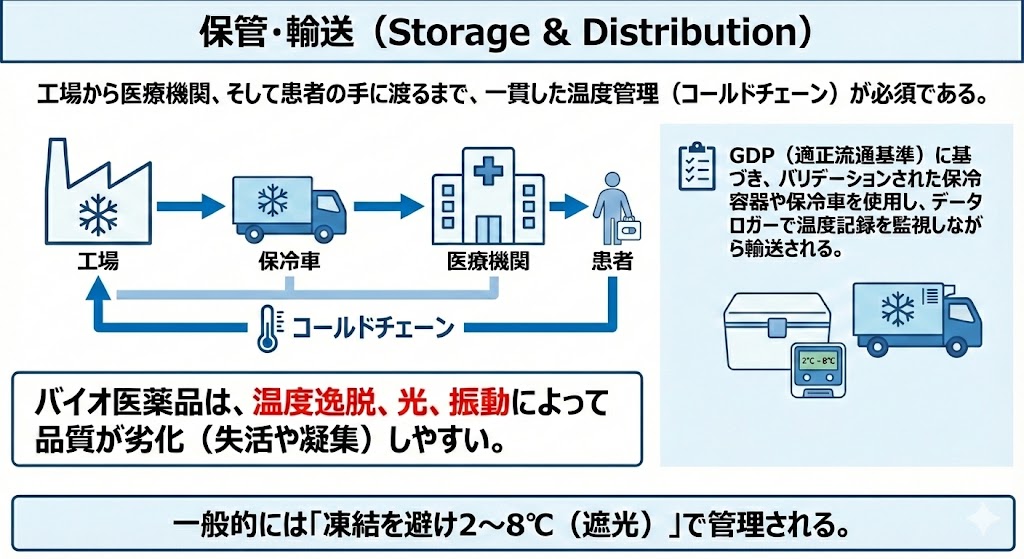
バイオ医薬品は、温度逸脱、光、振動によって品質が劣化(失活や凝集)しやすい。
そのため、GDP(適正流通基準)に基づき、バリデーションされた保冷容器や保冷車を使用し、データロガーで温度記録を監視しながら輸送される。一般的には「凍結を避け2〜8℃(遮光)」で管理される。
バイオ後続品(バイオシミラー)
バイオ後続品(バイオシミラー:Biosimilar)とは、特許が切れた先行バイオ医薬品と「同等・同質」であることを証明して承認された医薬品である。
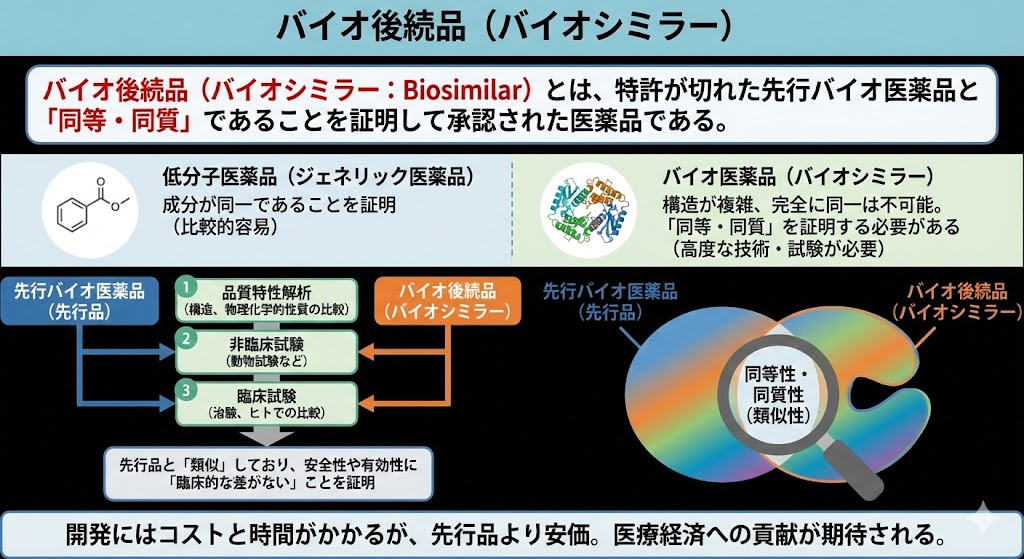
低分子の「ジェネリック医薬品」は成分が同一であることを証明すればよいが、複雑な構造を持つバイオ医薬品では「完全に同一のもの」を作ることは不可能である。
そのため、品質特性解析(構造や物理的化学的性質の比較)、非臨床試験、そして臨床試験(治験)を通じて、先行品と「類似しており、安全性や有効性に臨床的な差がないこと」を積み重ねて証明する必要がある。
開発には相応のコストと時間がかかるが、先行品よりは安価に設定されるため、医療経済への貢献が期待されている。
バイオ医薬品製造に関する主な用語解説
| CHO細胞 (Chinese Hamster Ovary cells) |
チャイニーズハムスター卵巣由来の細胞。ヒトに近い糖鎖修飾を行う能力があり、増殖性も良いため、抗体医薬品などのバイオ医薬品製造で最も多く利用されている宿主細胞。 |
|---|---|
| MCB / WCB (Master/Working Cell Bank) |
細胞の遺伝的安定性を保つためのシステム。 大元の「マスターセルバンク(MCB)」から、製造用に「ワーキングセルバンク(WCB)」を増やして使用する。これにより、長期にわたり均一な細胞を用いた製造が可能となる。 |
| ウイルスクリアランス (Viral Clearance) |
生物由来の原料を使用するため、ウイルス汚染のリスクを排除する工程。 ウイルスを死滅させる「不活化」や、極小のフィルターで取り除く「除去」工程を組み合わせ、安全性を保証する。 |
| クロマトグラフィー (Chromatography) |
混合物を分離・精製する技術。バイオ医薬品では、特定のタンパク質だけを吸着させる「アフィニティ」や、電荷の違いを利用する「イオン交換」などの樹脂(レジン)を使い分け、不純物を除去する。 |
| GDP (Good Distribution Practice) |
「医薬品の適正流通基準」。 製造工場から薬局・病院などの医療機関に納品されるまでの間、品質が劣化しないよう、温度管理や盗難防止などを適切に行うための基準。 |