医薬品製造における製薬用水の重要性と役割
医薬品製造において「水」は、単なる媒体ではなく、品質の一貫性と製品の安全性を担保する極めて重要な「原料」の一つである。国際的にも、日本薬局方(JP)、米国薬局方(USP)、欧州薬局方(EP)などの各極薬局方やGMPガイドラインに基づき、厳格な水質基準が定められている。
以下に、医薬品製造プロセスにおける水の主要な役割と必要性を整理する。
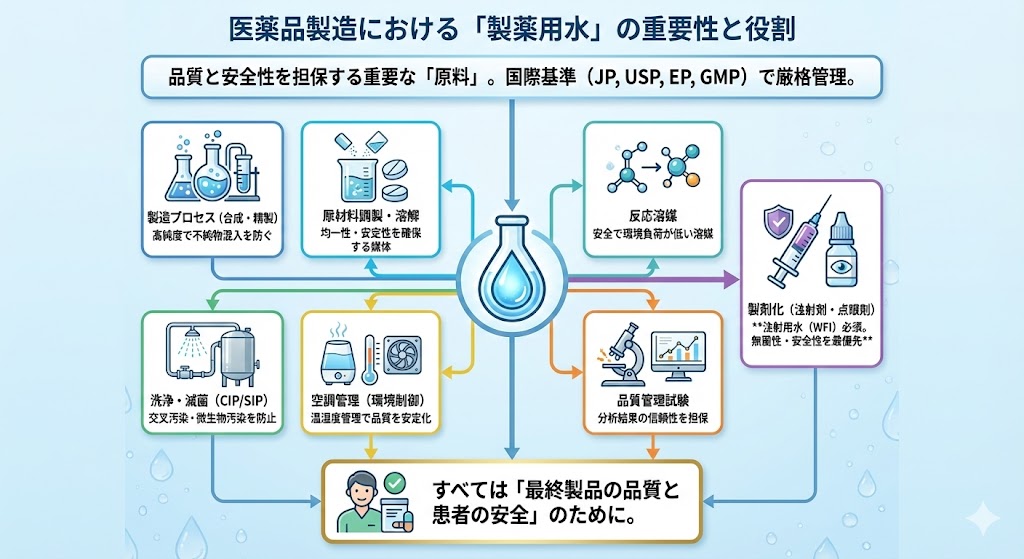
| 製造プロセスへの使用 | 医薬品の合成、反応、精製工程において、高純度な水が不可欠である。原材料や中間体との化学的相互作用を最小限に抑え、不純物の混入を防ぐことで、最終製品の品質を保証する。 |
|---|---|
| 原材料の調製・溶解 | 有効成分や添加剤の溶解・懸濁媒体として使用される。適正なpHやイオン強度を維持し、反応の進行や製剤の特性(均一性、安定性)を確保するために機能する。 |
| 洗浄および滅菌(CIP/SIP) | 製造装置、タンク、配管の洗浄(CIP)および蒸気滅菌(SIP)において、最も多量に使用される。クロスコンタミネーション(交叉汚染)や微生物汚染を防ぎ、清浄度レベルを維持するために、極めて高い水質管理が求められる。 |
| 反応溶媒としての利用 | 有機合成や晶析などの工程で、安全かつ環境負荷の低い反応溶媒として水が選択される。多くの有機・無機物質に対して良好な親和性を持ち、プロセスパラメータの制御を容易にする。 |
| 空調管理(環境制御) | 製造エリアの温湿度管理(空調機等の加湿用水)に使用される。適切な湿度の維持は、粉体の飛散防止や静電気対策、作業環境の安定化に寄与し、製品品質の均一性を支える。 |
| 製剤化(注射剤・点眼剤等) | 注射剤や点眼剤の製造には、エンドトキシン(発熱性物質)や微生物が厳格に管理された「注射用水(WFI)」が必須である。患者の血管内に直接投与されるため、無菌性と安全性の確保が最優先される。 |
| 品質管理試験 | 製品の最終検査や工程内検査(HPLCの移動相、溶出試験液など)において、分析結果の信頼性を担保するために、超純水などの高グレードな水が使用される。 |
医薬品の構成要素は有効成分(API)や添加剤が主であるが、製造工程全体を通じて最も多く触れ、かつ製品に含まれ得る成分が「水」である。
医薬品製造に使用される水は、総称して「製薬用水」と呼ばれ、常水、精製水、注射用水などに分類される。
製薬用水の用途は多岐にわたる。原材料の溶解や造粒時の結合液として添加される水は、乾燥工程を経たとしても、その品質履歴は最終製品に影響を与える可能性がある。
また、製品に直接接触する製造設備や容器類の洗浄・滅菌には、製品そのものと同等、あるいはそれ以上の清浄度が求められる水や蒸気が大量に使用される。
とりわけ注射剤においては、その溶媒のほとんどが「注射用水(Water for Injection: WFI)」であり、厳格な無菌管理とエンドトキシン管理が義務付けられている。
製薬用水の品質管理に不備があれば、水そのもの、あるいは水に含まれる残留成分(不純物や微生物)が最終製品を通じて人体へ摂取されるリスクがある。そのため、製薬用水は一般的な用水とは明確に区別し、厳格な管理下で製造・供給されなければならない。
医薬品製造において、打錠機や充填機など製品を直接加工する機械を「生産設備」と呼ぶのに対し、製造に必要な水、空調、圧縮空気などを供給する設備は「製造支援設備(ユーティリティ)」と定義される。
製造支援設備は、製品品質に重大な影響を及ぼす可能性があるため、生産設備と同様にGMP(医薬品の製造管理及び品質管理の基準)の適用対象となる。
製薬用水の品質を恒常的に確保するためには、システムが要求品質に適合した水を安定供給できることを適切なバリデーションによって科学的に検証するとともに、日常的な水質モニタリングを実施し、その品質を継続的に保証することが不可欠である。
製薬用水は、医薬品製造において使用される「水」であり、不純物が製品品質や試験結果、ひいては人体へ悪影響を及ぼさないよう、厳格な品質管理が求められる。
日本では「日本薬局方(JP)」により、製造方法や水質基準が明確に定義されている。大きく分けて、製造設備で製造・供給される「バルク水」と、容器に充填された「容器入り水(滅菌済み)」の2つに分類される。
一般的に、医薬品の製造ライン(仕込み、洗浄等)で使用されるのは「バルク水」である。以下に日本薬局方で定められた主な製薬用水の規格を示す。
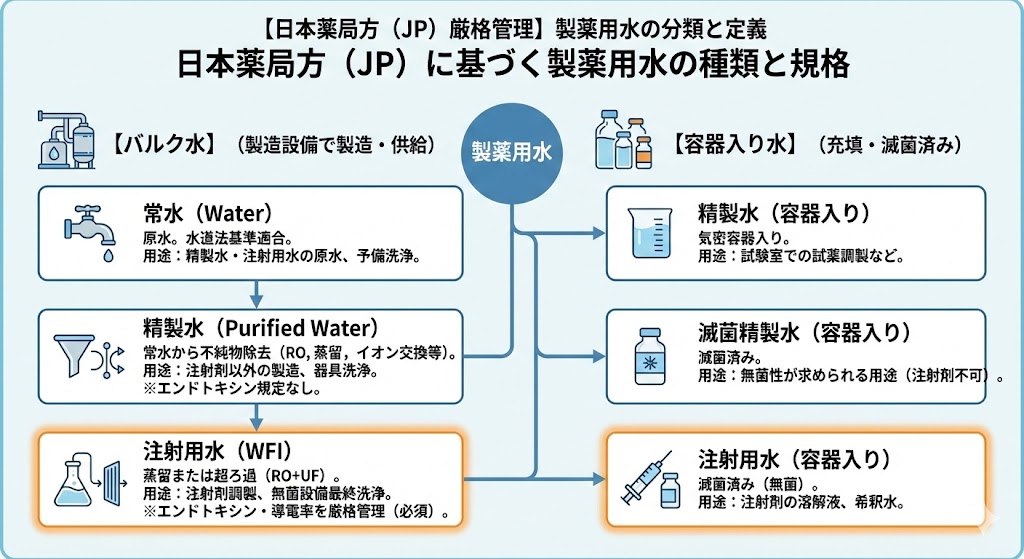
| 常水 (Water) |
水道法に基づく水質基準に適合した水。井水や工業用水を用いる場合は、前処理を行いアンモニウム試験(0.05mg/L以下)等に適合する必要がある。 主に製薬用水(精製水・注射用水)の原水として用いられるほか、中間体の製造や設備の予備洗浄に使用される。 |
|---|---|
| 精製水 (Purified Water) |
【バルク水】 常水を原水とし、イオン交換、逆浸透(RO)、蒸留、超ろ過(UF)などを組み合わせて不純物を除去した水。 注射剤以外の製剤の製造や、器具洗浄に用いられる。微生物管理は必要だが、エンドトキシン規定はない。 |
| 精製水(容器入り) | 精製水を気密容器に入れたもの。試験室での試薬調製などに用いられる。 |
| 滅菌精製水(容器入り) | 精製水を気密容器に入れ滅菌したもの、または無菌的に充填したもの。無菌性が求められるが、注射剤の調製には使用できない。 |
| 注射用水 (Water for Injection:WFI) |
【バルク水】 精製水または常水を原水とし、「蒸留」または「超ろ過(RO膜+UF膜などの組み合わせ)」により製造された水。 注射剤の調製や、無菌製剤用設備の最終洗浄に用いられる。エンドトキシンおよび導電率の厳格な管理が必須であり、超ろ過法を採用する場合は、膜の破断リスクを考慮した高度なバリデーションと日常管理が求められる。 |
| 注射用水(容器入り) (Sterile WFI in Containers) |
注射用水を気密容器に入れ滅菌したもの(無菌)。 用時溶解する注射剤の溶解液や、注射剤製造用の希釈水として用いられる。 |
水に含まれる不純物の管理指標として重要となるのが、導電率と全有機体炭素(Total Organic Carbon:TOC)である。
導電率は水中の無機塩類(イオン)の量を、TOC値は有機不純物の量をそれぞれ反映する指標である。日本薬局方(JP)における「精製水」と「注射用水」の各条には、これらについて厳格な基準値が設定されている。
| 精製水 | 有機体炭素(TOC):0.50mg/L以下 導電率:2.1μS/cm以下(25℃) |
|---|---|
| 注射用水 | 有機体炭素(TOC):0.50mg/L以下 導電率:2.1μS/cm以下(25℃) エンドトキシン:0.25EU/mL未満 |
また、水系における微生物の増殖は、単なる水質劣化にとどまらず、バイオフィルムの形成やエンドトキシン汚染のリスクを増大させる。
したがって、製薬用水の製造・貯蔵・供給システム全体において、生菌数(バイオバーデン)およびエンドトキシン濃度を常にモニタリングし、管理基準値以下に制御することが求められる。
製薬用水の選択は、最終製品の投与経路や製造工程のリスクに基づいて決定される。原則として、人体への侵襲性が高い製品や、プロセスの下流(最終製品に近い工程)ほど、不純物が限りなく少ない高品位な水が要求される。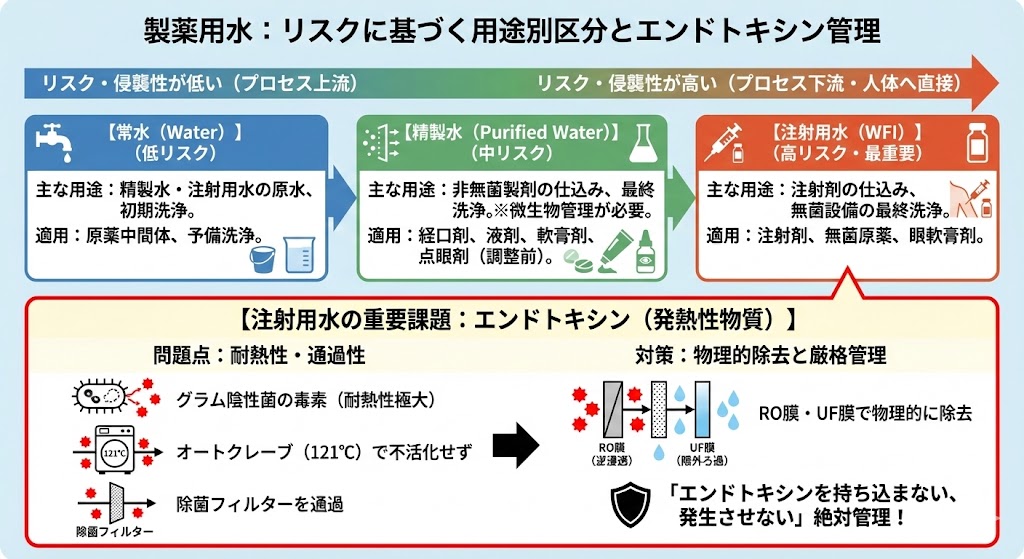
| 製薬用水区分 | 主な使用例 | 適用製剤・工程 |
|---|---|---|
| 常水 | 精製水や注射用水の「原水」として使用されるほか、原薬製造の初期段階や、設備の予備洗浄(一次洗浄)に使用される。 | 原薬中間体、予備洗浄 |
| 精製水 | 非無菌製剤の仕込み水や、器具の最終洗浄水として使用される。用途に応じ、微生物学的管理(アラート/アクションレベルの設定)が必要となる。 | 経口剤(錠剤・散剤等)、液剤、軟膏剤、点眼剤の成分調整前工程 等 |
| 注射用水 | 注射剤の仕込み水として必須である。また、無菌製剤の製造装置や容器、器具類の最終すすぎ(リンス)水としても使用される。 | 注射剤、無菌原薬、眼軟膏剤、無菌製剤設備の最終洗浄 等 |
注射用水において、特に警戒すべき対象がエンドトキシン(発熱性物質)である。
一般的な微生物は、最終滅菌(高圧蒸気滅菌等)や除菌フィルター(0.22μm等)によって死滅・除去が可能である。しかし、エンドトキシンはグラム陰性菌の細胞壁由来の毒素であり、耐熱性が極めて高い。
通常の高圧蒸気滅菌(オートクレーブ:121℃)では不活化されず、またサイズが小さいため除菌フィルターも通過してしまう。破壊には250℃以上での乾熱滅菌が必要となるが、水の状態では実施不可能である。
そのため、注射用水の製造においては、逆浸透膜(RO)や限外ろ過膜(UF)を用いて物理的に除去し、「エンドトキシンを系内に持ち込まない、発生させない」管理が絶対条件となる。