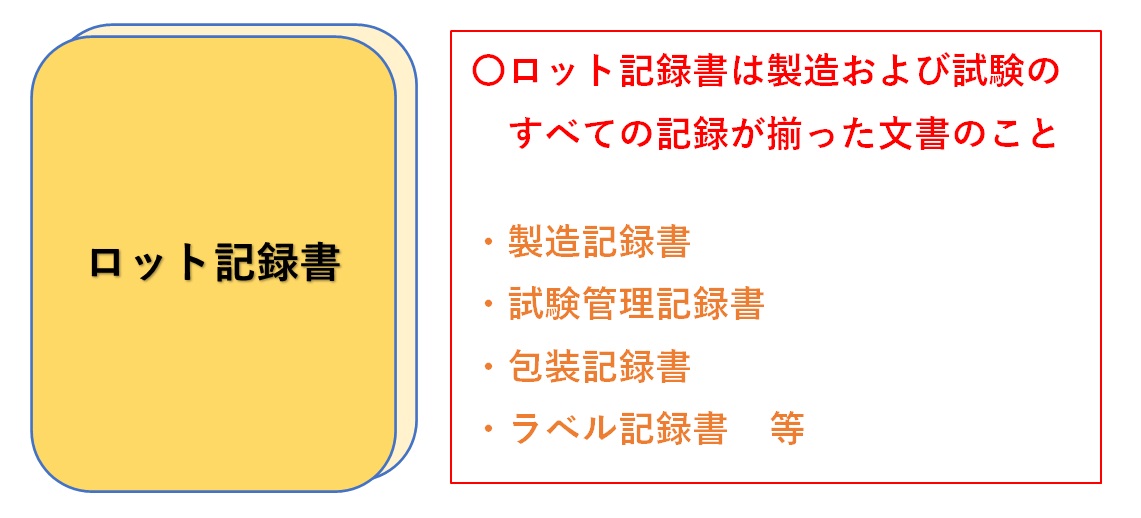
�����w�}���Ɛ����L�^��
�����w�}���Ɛ����L�^���́A�����ɋ�ʂ��ĊǗ�����K�v������B����́A�O�҂��u���ׂ���v�ł���A��҂��u���{�����؋��v�ł���Ƃ����A�ړI����ъǗ����F�v���Z�X�ɂ����錈��I�ȈႢ�ɂ����̂ł���B
�u�����w�}�����{�v�͐����̕W���菇���i�}�X�^�[�j�ł���A�u�����w�}���v�͂�������̐������b�g�ɓK�p���A������m�Ȏw����^���邽�߂ɔ��s����镶���ł���B
| �����w�}�����{ (Master Production Instruction / Master Batch Record) |
����: �����v���Z�X�S�̂��K�肵�A�ڍׂȎ菇��w�����`����u�}�X�^�[�����v�B���i���ƁA�H�����Ƃɍ쐬���K�{�ł���B ���e: �����̓������獬���A�����A�����A�����A�[�U�A��Ɏ���܂ŁA�S�H���̋�̓I�������ȑ���菇�A����ъǗ�����܂܂��B �ڍא�: �o�b�`���Ƃɏ��炷�ׂ�����菇�A���i�d�l�A�i����Ȃǂ��ڍׂɒ�`����Ă���A�����̐�ΓI�Ȋ�ƂȂ�B |
|---|---|
| �����w�}�� (Batch Production Instruction / Issued Batch Record) |
����: �����w�}�����{�̐��m�Ȏʂ��i�R�s�[�j�Ƃ��Ĕ��s����A���ۂ̐�������ō�Ǝw�����Ƃ��Ďg�p����镶���B ���e: ���{�̓��e�Ɋ�Â��A���Y�������b�g�ŗL�̐����w�}�ԍ��i���b�g�ԍ��j����\�萔�ʂȂǂ��t�L�����B �ڍא�: �����Ǝ҂͂��̎w�}���ɏ]���č�Ƃ��s���B���{�̐��m�ȃR�s�[��p���邱�ƂŁA�W���菇�̊��S�ȏ��炪�ۏ����B |
�����w�}�����{�́A���b�g�Ԃ̓��ꐫ�i�i���̈�ѐ��j��ۏ��邽�߂ɍ쐬�����B����i�ڂł����Ă����b�g�T�C�Y�i�d���ʁj���قȂ�ꍇ�́A�X�P�[���A�b�v/�_�E���ɔ����p�����[�^�̈Ⴂ�����邽�߁A���ꂼ��ʂ̌��{���K�v�ƂȂ�B

�ȉ��ɁA�����w�}�����{�̗v���ƊǗ��ɂ��Ď����B
�@�������w�}�����{�̒�`��
�@�@�����w�}���s�����߂́u�}�X�^�[�����v�ł���
�@�A�����J�n�O�ɂ����čł��d�v����{�ƂȂ镶���ł���
�@�B�e���i�A�e���b�g�T�C�Y���Ƃɂ��炩���ߍ쐬����i�����ʂ⌴�ޗ��̔z���ʂ͌Œ肳���j
�@�C���{�Ƃ��ĕi���ۏؕ���ɂ�茵�i�ɏ��F�E�Ǘ������
�@�D���ۂ̎w�}�����s���́A���F���ꂽ���{�̃R�s�[�ɔ��s�ӔC�҂��������s��
�@����ȋL�ڎ�����
�@�E���i���A���ԑ̖��A����
�@�E�����ԍ��i�Ǘ��R�[�h�j����єŐ�
�@�E���ޗ��A���ԑ̂̃��X�g�i���́A�i�ڃR�[�h���܂ށj
�@�E���ޗ����̐��m�Ȏg�p�ʁi�z���ʁj
�@�E�����ꏊ����юg�p�����v�����ݔ�
�@�E��̓I�ȍ�Ǝ菇
�@�E�v���Z�X�p�����[�^�i���x�A���ԁA��]�����j�Ƃ��̊Ǘ����i���e�͈́j
�@�E�H���������i�T���v�����O�j�̕��@����є���
�@�E���v���ԁi�^�C���X�^���v���K�v�ȍH���j
�@�E���ԑ̂���эŏI���i�̊��Ҏ��ʂƂ��̋��e�͈�
�@�E���L�����i���ӎ����A�N���e�B�J���|�C���g�j
�@�E�\���ޗ��A��ޗ��A�ۊǏ���
�@�E���i�������Ԓ��i�o�ה���҂��j�̕ۊǏ���
�@�����{�̏ƍ��Ə��F��
�@�@�쐬�҂����e���m�F���A���t�E�������L������
�@�AQA�i�i���ۏؕ��j���̏��F�҂������̑Ó����E���������m�F���A���t�E�������L�����ď��F����
�����w�}���́A�����̊�ƂȂ�ŏd�v�����ł��邽�߁A�L�ڎ����͑���ɂ킽��B���������āA���̌��ƂȂ�u�����w�}�����{�v�̊Ǘ��̐��͋ɂ߂ďd�v�ł���B
���{�̍쐬���́A�쐬�����̐ӔC�҂����e���m�F���ď������A�����QA�i�i���ۏؕ��j���ƍ��E���F���s�����ƂŁA�菇�̐�������S�ۂ���B
�܂��A���ł̌�g�p�h�~��A���Ȃ������E�������݂�h�����߁A�Ő��Ǘ����܂߂����d�ȕ����Ǘ������߂���B
�u�����L�^�����{�v����сu�����L�^���v�́A�����v���Z�X�̎��т��ؖ����A�i���m�F����ыK���v���iGMP�j�ւ̓K����ۏ��邽�߂̕����ł���B
| �����L�^�����{ (Master Manufacturing Record Template) |
����: �����L�^���c�����߂́u�l���i�e���v���[�g�j�v���`�����}�X�^�[�����B�ʏ�A�����w�}�����{�ƃZ�b�g�ŊǗ��A���邢�͈�̉��i�w�}�L�^���Ƃ��āj����Ă���B ���e: �L�^���ׂ����ځi�f�[�^�L�����A�m�F�A���藓�Ȃǁj���̏�ԂŐݒ肳��Ă���B �ڍא�: �ǂ̍H���ŁA���̃f�[�^���A�N�����L�^���邩�m�ɒ�`���A�L�^�̔����R���s������h���v�ƂȂ��Ă���B |
|---|---|
| �����L�^�� (Batch Manufacturing Record, BMR) |
����: �����L�^�����{���琶������A���ۂ̐������уf�[�^���L�����ꂽ�����B����̐������b�g�́u�������v�ƂȂ�B ���e: �����w�}�Ɋ�Â����{���ꂽ��Ƃ̌��ʁA����҂̏����A����l�A�g�p�ݔ���ID�A���ޗ��̃��b�g�ԍ��Ȃǂ��L�^�����B �ڍא�: ���{�ŋK�肳�ꂽ�l���ɏ]���A���ۂ̐����f�[�^���E���������f�����B�o�b�`���Ƃ̕i���ۏ̏؋��i�ؐՁj�Ƃ��ċ@�\����B |
�����L�^�����{���w�}�����l�A���b�g�T�C�Y���Ƃɍ쐬�E�Ǘ�����B
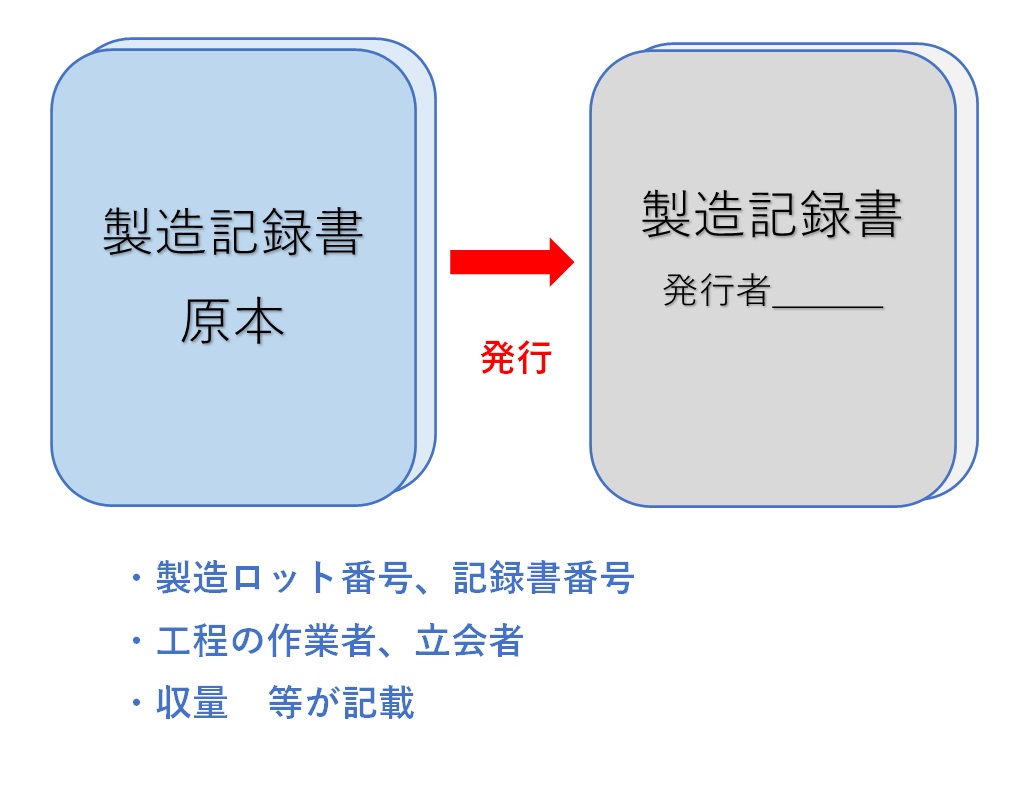
���ۂ̐������ɂ́A�L�^�����{���R�s�[�i���s�j���A���s�ӔC�҂��L�^���ԍ��i���b�g�ԍ����j��t�ԁA���t���L�ڂ��ď������s���B
�����L�^���ɂ́A���̃��b�g�̐�������ъǗ��Ɋւ���S�Ă̏����L�ڂ��Ȃ���Ȃ�Ȃ��B
��Ɠ����A�g�p�ݔ��A�e�푪��l�A��ƎҁE����҂̏����A���ʁA����сA����ɂ͈�E�������̋L�^�Ɏ���܂ŁA���������ԗ����A�f�[�^�C���e�O���e�B�i���S���j��S�ۂ���B
�@�����s��
�@�E���b�g�T�C�Y���Ƃɏ��F���ꂽ�����L�^�����{��p�ӂ���
�@�E���{���R�s�[���A���Y���b�g�p�̐����L�^���Ƃ��Ĕ��s����
�@�E�L�^�����s�҂��A�Ǘ��ԍ��i�L�^���ԍ��j��t�Ԃ��A���s���A�������L�ڂ���
�@����ȋL�^���ځ�
�@�E�L�^���ԍ��i�����ԍ��j�A���s���t
�@�E��Ǝ��{���A��ƊJ�n�E�I������
�@�E�g�p�����ݔ��i�����ʁA�����@�A���Ӌ@���̋@��ID�j
�@�E���i���b�g�ԍ�
�@�E�g�p���ޗ��̖��́A���b�g�ԍ��A���ʒl�i�d��/�e�ʁj
�@�E�H���p�����[�^�i���x�A���́A��]�����̎��ђl�j
�@�E�d�v�H���ɂ������Ǝ҂���ї���҂̏����i�_�u���`�F�b�N�j
�@�E�H�����T���v�����O���{��
�@�E�H���������̍��ڂ���ь���
�@�E���ԑ̎����ʁA���i������
�@�E����ނ̎g�p���т���у��x�����{
�@�E��E�������̋L�^�i�]���A�������ʁA�֘A�����ԍ��j
�@�E���۔��茋��
�����L�^�����{�́A�����w�}���̓��e�Ɛ�����������悤�쐬�����B
�Ő��Ǘ���O�ꂵ�A���ł̌�g�p��A���{�ւ̕s�K�ȏ������݁E���ς��s���Ȃ��悤���d�ɊǗ�����B
�y�|�C���g�z
1. �f�[�^�C���e�O���e�B�iDI�j��ALCOA+����
�ߔN�A�����L�^���ɂ����čł��d�������̂��u�f�[�^�C���e�O���e�B�i�f�[�^�̊��S���j�v�ł��B�L�^�́AALCOA+�̌����i�A�����A���ǐ��A�������A���{���A���m���Ȃǁj�����K�v������܂��B���Ɂu�����L�^�i��Ƃ������̏u�ԂɋL�^����j�v�͓O�ꂪ�K�v�ŁA������������̓]�L�Ȃǂ͌��ւƂ���Ă��܂��B
2. �u���{�v�̃f�U�C�����~�X��h��
�����~�X��L�^�~�X�i�L���R��Ȃǁj�̑����́A���́u�����w�}�L�^�����{�v�̃��C�A�E�g�̈����ɋN�����邱�Ƃ�����܂��B�v�Z���L����A�L�������L�����A�d�v�H���ɂ̓_�u���`�F�b�N����݂���ȂǁA��Ǝ҂����킸���m�ɋL�^�ł���u���[�U�[�t�����h���[�Ȍ��{�v�v���A�i�����X�N�������錮�ƂȂ�܂��B
3. �d�q���̗���iMES�j
�{�e�ł͎��x�[�X�̉^�p��������܂������A���݂�MES�i�������s�V�X�e���j�̓����ɂ��A�w�}�ƋL�^���f�W�^���������P�[�X�������Ă��܂��B�������A�f�W�^���̏ꍇ�ł��u���F���ꂽ�}�X�^�[�i���{�j�v�Ɓu���s�f�[�^�i�L�^�j�v�̊W���͕ς��܂���B�ނ���A�V�X�e���o���f�[�V�����ɂ���āA��茵���ȊǗ������߂��܂��B
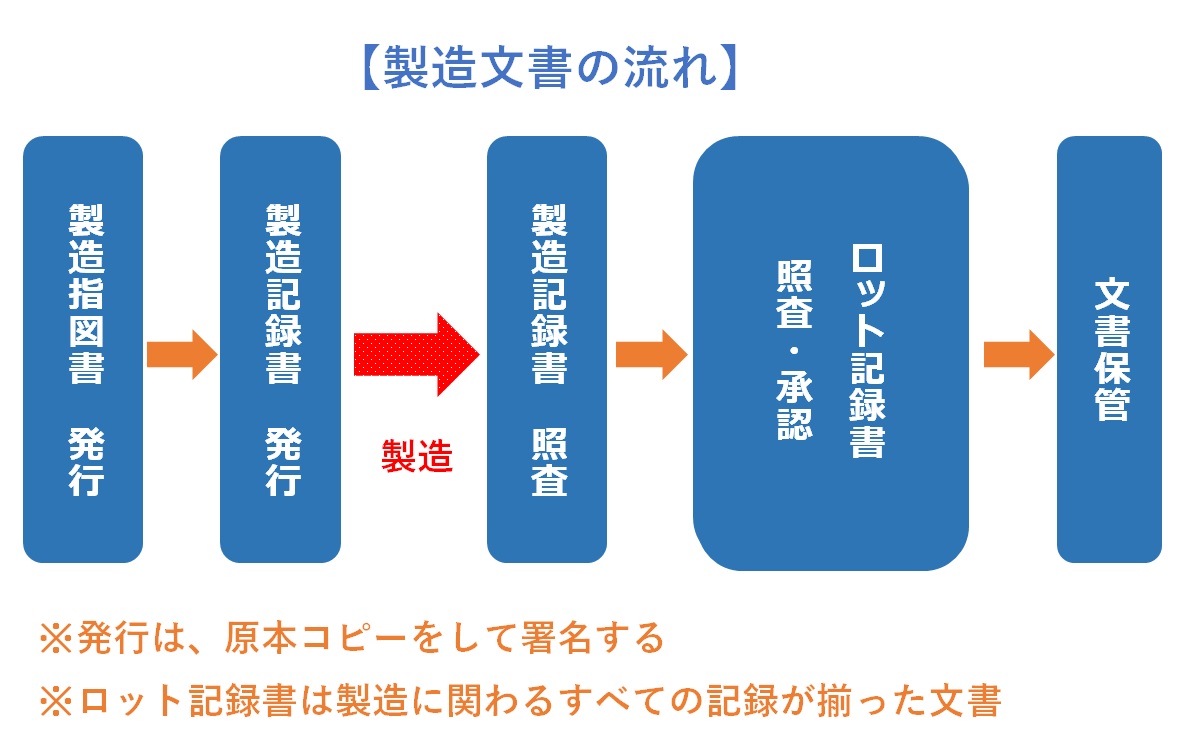
�����v���Z�X�́A���F���ꂽ�菇�Ɋ�Â��u�����w�}���̔��s�v����J�n�����B�����w�}�����{���R�s�[���A���s�ӔC�҂��������s�����ƂŁA���Y���b�g�̐������������B
�����āA�w�}���ɑΉ������u�����L�^���v�s����B����������{���R�s�[���A���s�ӔC�҂��������s�����ƂŁA�����ȋL�^�}�̂Ƃ��ċ@�\����B
�e�����̏��F�E���s��A���ۂ̐�����Ƃ��J�n�����B��Ƃ̐i���ɔ����A���茋�ʁA����҂̏����A�g�p���ޗ��̋L�^�Ȃǂ��A�����L�^���փ��A���^�C���ɋL�ڂ����i�����L�^�̌����j�B
������A��E��OOS�i�K�i�O�������ʁj�����������ꍇ�́A���₩�ɕ����쐬���A�����L�^�⌋�_���L�ڂ������ނ��L�^���ɓY�t�E��������B�����͏o�ה���ɂ�����d�v�Ȕ��f�ޗ��ƂȂ�B
����������A�����ӔC�҂������L�^���S�̂��ƍ����A�L�^�̐��m���A�H���̊����A����ю菇�̏�����m�F����B
���̐����L�^���ɁA�����Ǘ��L�^���iQC�f�[�^�j�A��L�^���A���x���L�^���ȂǁA���Y���b�g�Ɋ֘A����S�Ă̋L�^�����A�u���b�g�L�^���i�o�b�`���R�[�h�j�v�Ƃ��Ă܂Ƃ߂�B
�ŏI�I�ɁAQA�i�i���ۏؕ��j�����b�g�L�^�����ƍ��E���F���A���Y���b�g�̎s��ւ̏o�ۂ����肷��B����QA�ɂ��ƍ��E���F�v���Z�X���A���i���o�ה���iBatch Release�j�ɂ�����ŏd�v���ڂƂȂ�B
���F���ꂽ���b�g�L�^���́AQA����ɂ���ēK�ɕۊǁE�Ǘ������̂���ʓI�ł���A�@�Œ�߂�ꂽ���ԁA�����\�ȏ�Ԃŕۑ������B
�y�p�����z
| �����w�}�� | ���i�̐����ɂ����āA�g�p���錴���A���ʁA�����菇�A���ӎ����Ȃǂ��ڍׂɋL�ڂ��������BGMP�Ɋ�Â��A���b�g���Ƃɔ��s�E�Ǘ������B |
|---|---|
| �����L�^�� | �����w�}���Ɋ�Â����{������Ƃ̋L�^�B��Ƃ̎��{�����A�S���ҁA����f�[�^�Ȃǂ��L�^���A�������K�ɍs��ꂽ���Ƃ��ؖ����镶���B |
| �����L�^�̌��� | ��Ƃ����{�������̎��i���A���^�C���j�ɋL�^���c���Ƃ����A�f�[�^�C���e�O���e�B�i�f�[�^�̊��S���j�ɂ������{�I�Ȍ����B�L���ɗ���������̋L�^�͋֎~����Ă���B |
| ��E | �����菇���iSOP�j����w�}�����̒�߂�ꂽ�����O�ꂽ�s�ׂ⎖�ۂ̂��ƁB�i���ւ̉e���]���ƋL�^���`���t������B |
| OOS (Out of Specification) | �K�i�O�������ʂ̂��ƁB�i�������̌��ʂ��A�\�ߒ�߂�ꂽ�K�i�l�������Ȃ�������Ԃ��w���B |
| ���b�g�L�^�� �i�o�b�`���R�[�h�j |
�����L�^���A�����L�^���A��E���ȂǁA����̃��b�g�Ɋւ���S�Ă̋L�^���܂Ƃ߂������ꎮ�B���i�̃g���[�T�r���e�B���m�ۂ��邽�߂̍ŏd�v�����B |
| �o�ה��� �iBatch Release�j |
�����y�ѕi���Ǘ��̌��ʂ𑍍��I�ɕ]�����A���i���s��֏o�ׂ��ėǂ����肷��ŏI�v���Z�X�B�i���ۏiQA�j����̐ӔC�҂��s���B |