ジェネリック医薬品とは!?
ジェネリック医薬品は、先発医薬品に対する言葉として、“後発医薬品”と呼ばれる。
先発医薬品とは文字通り、先に開発された医薬品である。この先発医薬品と同じもので後から開発された医薬品が後発医薬品、すなわちジェネリック医薬品である。
薬は、9〜17年もの歳月と、数百億円以上の費用をかけて開発されるので、開発した製薬会社は、特許の出願によりその期間、その薬を独占的に製造・販売する権利が与えられる。
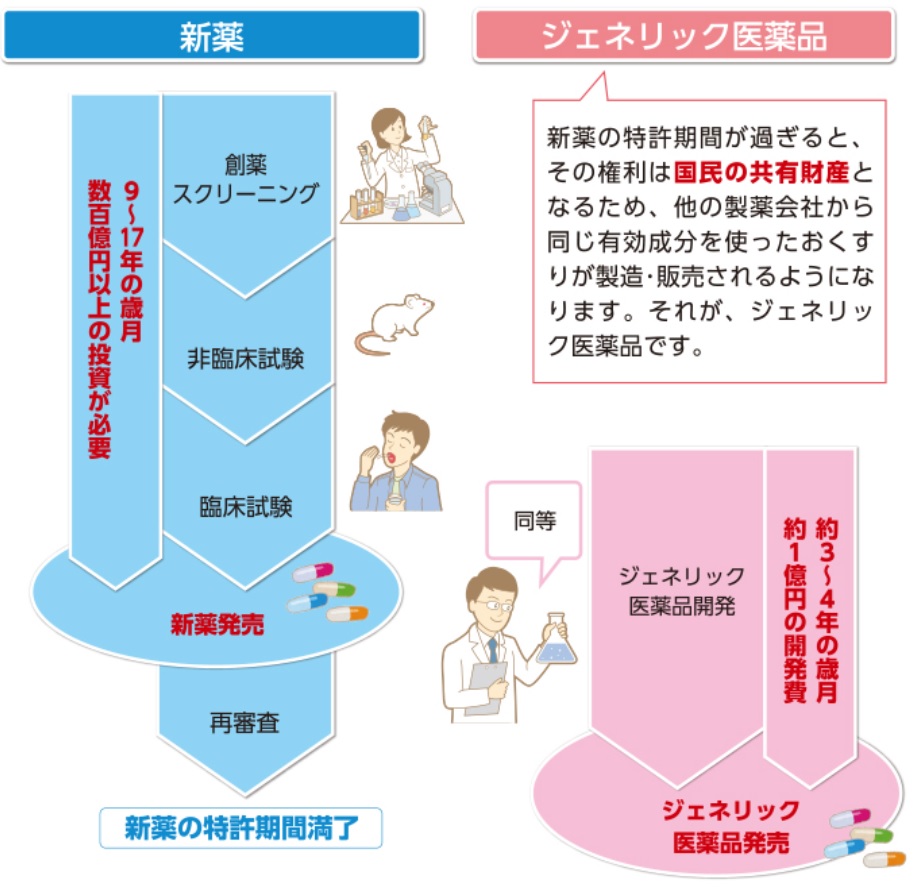
しかし、特許期間が過ぎると、その権利は国民の共有財産となるため、他の製薬会社から同じ有効成分を使った薬が製造・販売できるようになる。それが、ジェネリック医薬品である。新薬に比べ開発費や開発期間が少ないために、新薬より低価格で提供できる。
ジェネリック医薬品は、新薬(先発医薬品)と同じ有効成分を使っており、品質、効き目、安全性が同等な薬である。
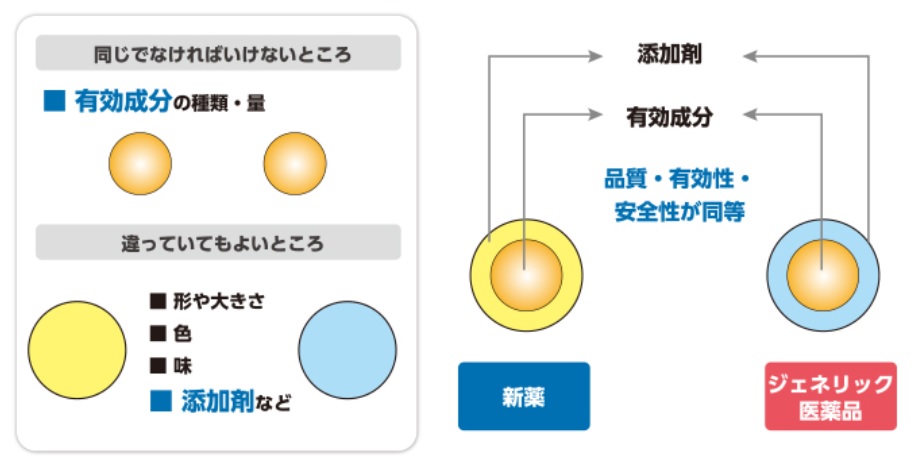
ただし、有効成分以外の添加剤が異なる場合がある。
添加剤は、それ自体では人に対して薬理作用がなく、安全性も確認されたものだけを使用している。新薬、ジェネリック医薬品問わず、共に広く医薬品に使用されているものである。
新薬と、色や形、味や香りなどの添加剤が異なる場合があるが、有効成分の種類と量が同じであり、効き目に差はない。
ジェネリック医薬品の中には、新薬と色や形が違うものもある。
これは新薬が発売されてからジェネリック医薬品が発売される間の製造技術の進歩や、製薬企業の製剤開発の工夫により、飲みやすく改良するためである。
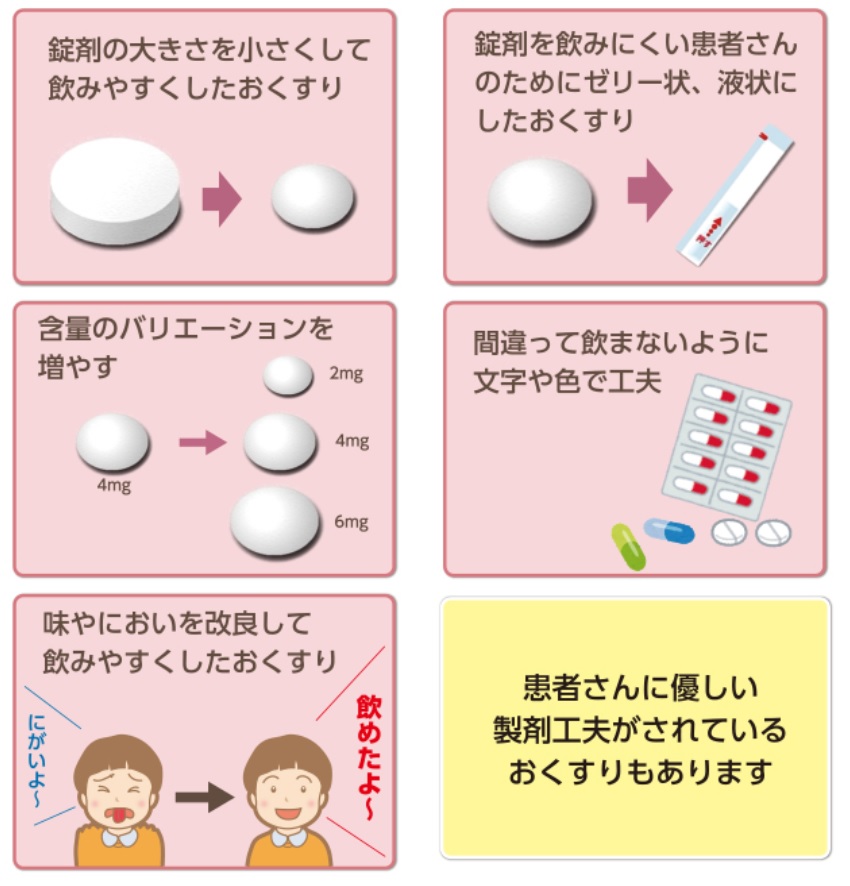
色や形、味や香りなどが異なる場合があるが、効き目に差はない。
ジェネリック医薬品は、厳しい試験に合格し、厚生労働大臣の承認を受け、国の基準、法律に基づいて製造・販売している。
ジェネリック医薬品の場合、成分については、有効性、安全性がすでに先発医薬品の承認の際に確認されているので、承認審査の中心は品質の確認と先発医薬品と同等性の確認となる。
したがって、承認申請に際して提出する資料も、
1)規格および試験方法に関する資料
2)安全性に関する資料
3)生物学的同等性に関する資料
に限定される。
ジェネリック医薬品は医療用医薬品であるため、薬価制度と関係抜きにジェネリック医薬品を語ることはできない。
ジェネリック医薬品の薬価は先発医薬品の薬価より低く設定されるため国民医療費の軽減に寄与することが期待されている。