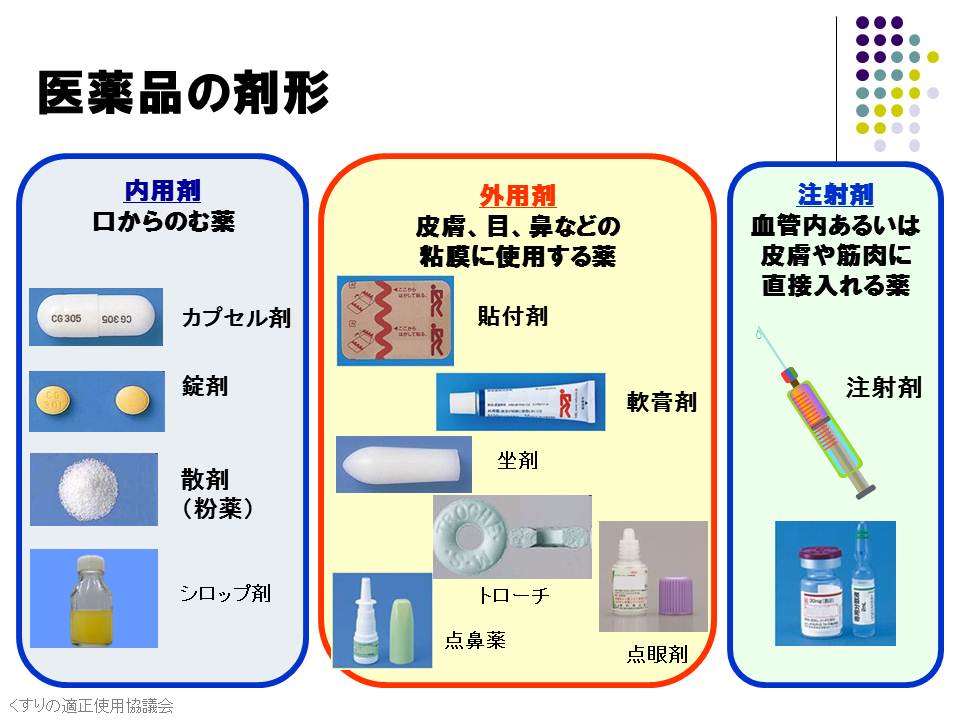
医薬品製造に関わる基礎知識をまとめて紹介します。医薬品と食品の違いとは?医薬品をつくる工程で大切なことをまとめました。
添付文書の電子化
添付文書の電子化
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下「薬機法」)の改正により、2021年8月から、これまで医薬品などの製品と一緒に同梱されていた紙の添付文書は原則として廃止され、電子的な方法で閲覧することが基本となる。
ただし、要指導医薬品や一般用医薬品(OTC医薬品)、一般用医療機器は対象外である。
また、2021年8月1日〜2023年7月31日までは経過措置期間として、電子的な提供と紙の添付文書の同梱を並行して行うことが認められる。
なぜ添付文書を電子化するのか
これまで、医薬品や医療機器の添付文書は頻繁に情報が改訂されるため、臨床現場で参照される添付文書が必ずしも最新のものではないことが問題となっていた。
また、同じ添付文書が同一医療機関に多数存在し、紙資源が無駄になっているといった問題も指摘されていた。
そのため、添付文書情報の提供方法が見直され、医薬品医療機器等法(薬機法)改正に伴って2021年8月1日から、紙の添付文書に代わりインターネットを介して「注意事項等情報」として、提供されることになった。
添付文書の電子化後の添付文書閲覧方法
改正薬機法が施行される2021年8月以降は、医薬品等が入っている箱につけられた「バーコードまたは二次元コード」をスマートフォンやタブレットのアプリケーションなどを使って読み取り、その情報をもとにインターネットを経由して最新の添付文書にアクセスし、電子的に閲覧することが基本となる。
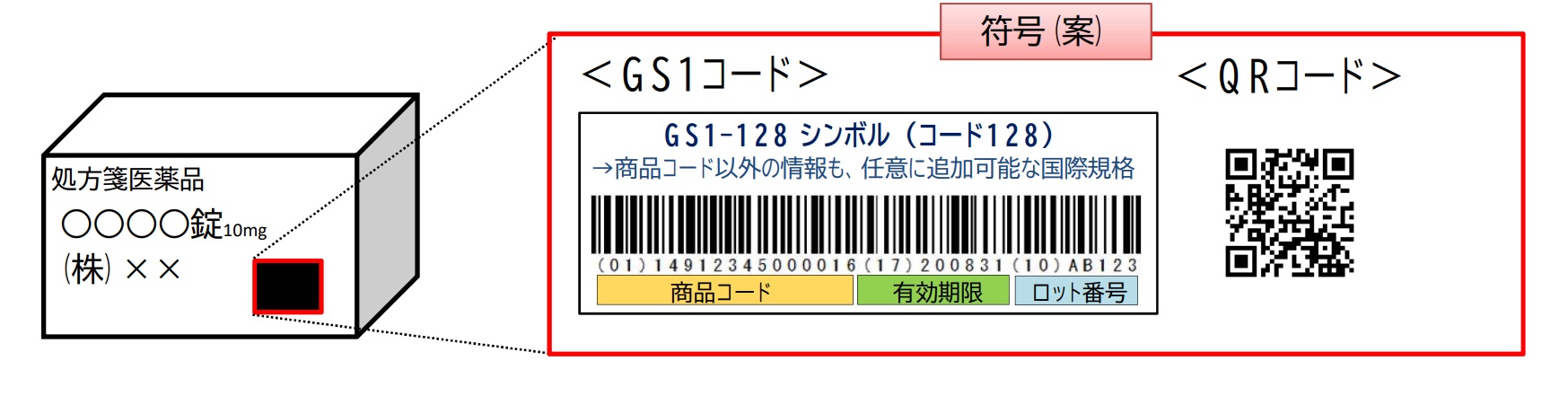
これにより常に最新の情報を使って安全対策を行うことが可能となる。
また、箱につけられたバーコード等からは、添付文書の他、審査報告書などの関連文書も閲覧することが可能である。
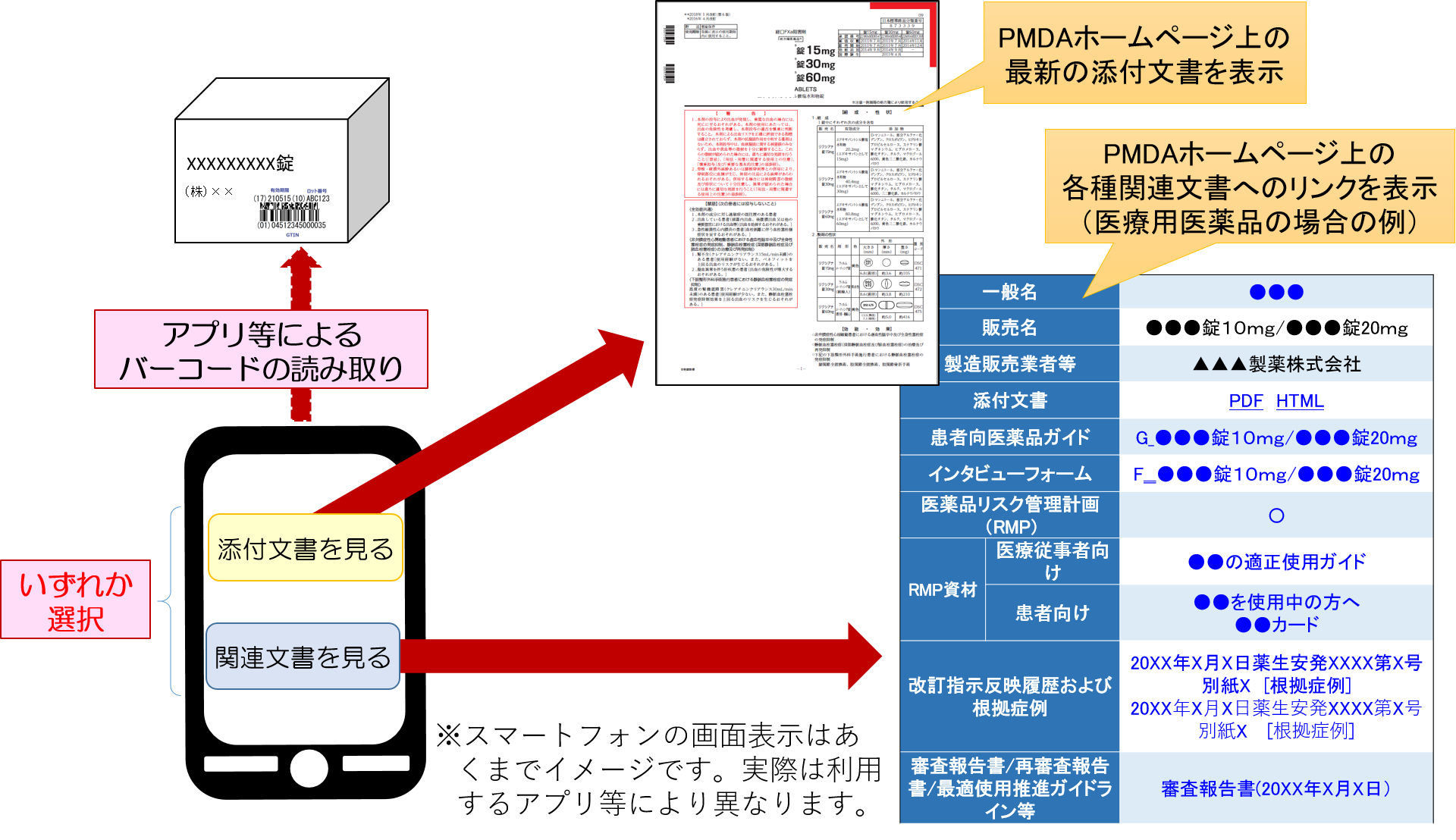
表示される関連文書
| 品目 | 表示される関連文書 |
|---|---|
| 医療用医薬品 (医療従事者向け) |
・添付文書、患者向医薬品ガイド ・ワクチン接種を受ける人へのガイド、インタビューフォーム、医薬品リスク管理計画(RMP)、RMP資材、改訂指示反映履歴および根拠症例、審査報告書 ・再審査報告書 ・最適使用推進ガイドライン等 |
| 医療用医薬品 (一般の方向け) |
・患者向医薬品ガイド ・ワクチン接種を受ける人へのガイド、くすりのしおり、RMP資材(患者向け)、重篤副作用疾患別対応マニュアル |
| 医療機器 | ・添付文書、改訂指示反映履歴、審査報告書 ・再審査報告書等、緊急安全性情報 |
| 体外診断用医薬品 | ・添付文書、緊急安全性情報、安全性速報、医薬品の適正使用等に関するお知らせ |
| 再生医療等製品 | ・添付文書、改訂指示反映履歴、審査報告書 ・申請資料概要 ・最適使用推進ガイドライン等、緊急安全性情報、安全性速報 |
添付文書閲覧アプリ「添文ナビ」 とは!? についてはこちら