�V�^�R���i�E�C���X�̎��Ö�E���N�`���J���i�V�����j
�T�`�P�P���N�`���ڎ� ���Ᏻ�F�i2022�N1���j
�@�����J���Ȃ́A�T�`�P�P��ڎ�Ώۂɂ����ăt�@�C�U�[���̐V�^�R���i�E�C���X���N�`����1��21���ɓ��Ᏻ�F�����B
�@��l��3����1�̗ʂ��A3�T�Ԃ̊Ԋu��2��ڎ킷��Ƃ������ƂŁA���{�͑������3���ȍ~�̐ڎ�J�n��z�肵�Ă���B
�@���{�����Ȋw��Ȃǂ̐����ɂ��ƁA5����11�̎q�ǂ������N�`����ڎ킵���ꍇ�A�V�^�R���i�̔��ǂ�h�����ʂ�����ق��A���Ɋ�b�����̂���q�ɂ��Ă͏d�lj���h�����Ƃ����҂����B
�@����ŁA�ڎ�ɂ���đz�肳��郊�X�N�ɂ��ẮA���M�⓪�ɁA���ӊ��A�܂�ɋN������̂Ƃ��ĐS�؉���S��������������B
�@�A�����J�̗Տ������ł́A5�`11�̎q�ǂ���16�`25�܂ł̐l�Ɣ�ׂĐڎ��ɕ��������o��p�x���Ⴉ�����Ƃ̕���B
�������ƂȂ�V�^�R���i�������ݖ�u�����k�s���r���v����Ᏻ�F�i2021�N12���j
�@�����J���Ȃ́A�V�^�R���i�E�C���X�̈��ݖ����Ᏻ�F�����Ɣ��\�����B
�@�R���i�����ɊJ�����ꂽ���ݖ��F�����͍̂������ƂȂ�B
�@���F���ꂽ�̂̓A�����J�̐�����u�����N�v���J�������R���i�̌y�ǂ⒆���nj��������ݖ�u�����k�s���r���v�ŁA�Տ������ł͓��@�⎀�S�̃��X�N��3���������Ƃ����B

�@18�Έȏオ�ΏۂŁA4�����������2��A5���ԕ��p����B
�@�V�^�R���i�E�C���X�����ǂ̎��Ö���u�A�r�K���v�ɂ��Č����J���Ȃ́A�ώ@�����̂��߂̒��I�������B
�@���ݖ�u�����k�s���r���v�i���i���E���Q�u���I�j�����p�������ȂǐV�^�R���i�f�Â�����̕ω��܂������f���Ƃ����B
�@�ώ@�����́A������܂����`�ōs���A���N�V���P���܂łɖ�P���T�O�O�O�l�ɓ��^���ꂽ�B
�V�^�R���i�E�C���X�̐V�ψي��u�I�~�N�������v���E�e�n�Ŋg��i2021�N11���j
�@�V�^�R���i�E�C���X�̐V���ȕψي��u�I�~�N�������v�B
�@��A�t���J����WHO(���E�ی��@��)�ɏ��߂ĕ��ꂽ�̂�2021�N11��24���B
�@����2����ɂ�WHO��VOC(���O���ׂ��ψي�)�Ɏw�肵�A���E�e���ŋ}���Ɍx�������܂����B
�@�I�~�N�������̊������m�F�E���ꂽ�̂́A2021�N12��4�����_�Ő��E40�ȏ�̍��E�n��ɍL�������B
�t�@�C�U�[�̐V�^�R���i�E�C���X���ݖ�@�Տ��������ʂ����\�i2021�N11���j
�@������t�@�C�U�[�́A�V�^�R���i�E�C���X�����ǎ��Ö�Ƃ��ĊJ�����̈��ݖ�ɂ��āA�d�lj��̋��ꂪ���鐬�l�̓��@�܂��͎��S�̃��X�N��89���ቺ�����Ƃ���Տ��������ʂ����\�����B

�@�V�^�E�C���X�o�����Ö�u�p�N�X���r�h�v�́A�d�lj����X�N�������l�ɑ��A���ǂ��炷���Ɏg�p����Ƃ������́B3����1��2��A5���ԕ��p����B
�@�t�@�C�U�[�́A�����̎������ʂ����ɗǍD���������Ƃ���A�Տ������𑁊��ɑł������Ƃ����B
�@���Ђ̓p�N�X���r�h�̗Տ������̒��Ԍ��ʂ�ĐH�i���i�ǁiFDA�j�ɒ�o����\�肾�Ƃ��Ă���B
�A�X�g���[�l�J�̃��N�`�����{�ł̐ڎ�J�n�i2021�N8���j
�@�A�X�g���[�l�J���̃��N�`���́A�܂�Ɍ����������郊�X�N�����邱�Ƃ�������A����܂œ��{���{�͌��I�\�h�ڎ�ɂ͎g�p���Ă��Ȃ������B
�@�������A�V�^�R���i�E�B���X�̊����g�傪�����Ă���A1���̊����Ґ��u�ߋ��ō��v���X�V�������Ă���B�A�X�g���[�l�J���̃��N�`���g�p���ɂ́A���N�`���s���̔w�i���݂���B
�@�ً}���Ԑ錾���o����Ă��铌���s�Ȃǂɏd�_�I�ɔz�����A�����Ƃ���40�Έȏ�̐l���ΏۂƂȂ�B
�@�܂��A�A�����M�[�̂��߃t�@�C�U�[����f���i���̃��N�`�����łĂȂ��l���ΏۂƂȂ�B
���f���i�ƃA�X�g���[�l�J�̃��N�`�����F�i2021�N5���j
�@�����J���Ȃ�5��21���A�ăo�C�I������f���i�А��Ɖp�������A�X�g���[�l�J�А��̐V�^�R���i�E�C���X���N�`���𐳎��ɏ��F�����B
�@20���Ɍ��J�Ȃ̐�啔��A�ً}���Ȃǂ̏����̉��Œʏ�����葱�����ȗ����ł����u���Ᏻ�F�v�ɂ�鏳�F�𗹏����Ă����B
�@���f���i����24�����瓌���A���ɍ����J�݂����K�͐ڎ�Z���^�[�ȂǂŎg�p���n�߂�B
�@����A�A�X�g���[�l�J���ɂ��Ắu���O���ɂ����鍂��҈ȊO�̑w�ւ̐ڎ퐄���̏Ȃǂ𒍎����Ȃ���A�䂪���ɂ�����g�p�̂�����ɂ��Ĉ���������������v�Ƃ��Ă���B
�@�A�X�g���[�l�J�ɂ��ẮA�ڎ��Ɍ������ł����Ȃǂ�����Ă��āA���J�Ȃ͌������������ꍇ�̎��Â̎w�j���쐬����Ƃ��Ă���B
�@���Ǘ\�h�̌��ʂ������L�����́A�t�@�C�U�[���u94.6���v�A���f���i���u94.1���v�A�A�X�g���[�l�J�́u70.4���Ȃǁv�ƂȂ��Ă���B
�@���f���i���u���b�Z���W���[RNA���N�`���v�ŁA�A�X�g���[�l�J���u�E�C���X�x�N�^�[���N�`���v�ƌĂ��^�C�v�B
�@�u�E�C���X�x�N�^�[���N�`���v�́A�V�^�R���i�E�C���X�̈�`�����̈ꕔ���A�`���p���W�[�Ɋ�������A�f�m�E�C���X�ɓ���čזE�܂ʼn^�ԁB�����āA�Ɖu�̂����݂ŐV�^�R���i�͂ɂ���R�̂�̓��ł��点��Ȃǂ��āA�{���̊����ɔ�����B
�o���V�`�j�u�@����3��ڂ̃R���i���Ö�i2021�N4���j
�@�����J���Ȃ̐�啔��́A�߃��E�}�`��Ƃ��ď��F����Ă���u�o���V�`�j�u�v�i���i���I���~�G���g�j��V�^�R���i�E�C���X�����ǂ̎��Ö�Ƃ��Ďg�p���邱�Ƃ𗹏������B
�@�ăC�[���C�����[���J�������u�o���V�`�j�u�v�́A�Ɖu�ُ�ɂ�鉊�ǂ�}�����B
�@�V�^�R���i�E�C���X�ɂ��x���ŁA�_�f�z�����K�v�Ȓ����ǂ���d�ǂ̊��҂�ΏۂɁA���Ᏻ�F����Ă���R�E�C���X��u�����f�V�r���v�ƕ��p�̓��^��O��Ƃ��Ă���B
�Đ�����t�@�C�U�[�̐V�^�R���i�E�C���X���N�`�����F�i2021�N2���j
�@�����J���Ȃ�2��12���A�E�H�i�q���R�c��̐�啔����J���A�Đ������t�@�C�U�[���\�������V�^�R���i�E�C���X���N�`���̏��F�𗹏������B
�@�ً}���ɐR�����ȗ����ł����u���Ᏻ�F�v�Ɋ�Â��A�������̐V�^�R���i���N�`���Ƃ��Đ������F�B
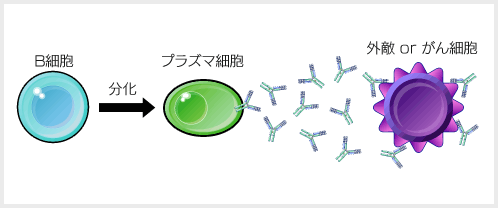
�@���Ѓ��N�`���́A��`�����L�^�����u���b�Z���W���[RNA�v�̈ꕔ��l�H�������č쐻�B
�@�ڎ��A�̓��ɐV�^�R���i�̂���ς���������A����ɑ���R�̂��ł��ĖƉu���l������B
�@���Ђ̗Տ������i�����j�ł͖�95���̗\�h�������m�F���ꂽ�B
�@�ڎ핔�ʂ̒ɂ݂Ȃǂ����蓾�邪�A�d�Ăȕ������͂قƂ�ǂȂ��Ƃ���A���ĂŐڎ킪�i�ށB
�@�����ł́A�V�^�R���i���N�`���̐�s�ڎ킪2��17���Ɏn�܂����B
�A�r�K���A�R���i���Ö�̏��F������i2020�N12���j
�@�����J���Ȃ̐�啔��́A�x�m�t�C�����z�[���f�B���O�X�̎q��ЁA�x�m�t�C�����x�R���w�́u�A�r�K���v�ɂ��āA�V�^�R���i�E�C���X���Ö�Ƃ��ď��F���邩�ǂ������f�����������B
�@���i�R���Ǘ��ۂ́u�����܂ŐR�c�̓r���ł���A�L�������ے肳�ꂽ���̂ł͂Ȃ��v�Ƃ��Ă���B��Б��ɂ�鎡�����A�ǂ̊��҂ɃA�r�K���𓊗^����������t���c�����čs�����u�P�ӌ������v���������Ƃ̉e���Ȃǂ��c�_�����B
�@���ݎ��{���̗Տ������ȂNJ�Ƃ���lj��̃f�[�^�̒�o��҂��Ă���ēx�R�c����Ƃ��Ă���B
�@�u�����_�œ���ꂽ�f�[�^����͗L�����m�ɔ��f���邱�Ƃ͍���v�Ƃ����B
�f�L�T���^�]���@����2��ڂ̃R���i���Ö�i2020�N7���j
�@�V�^�R���i�E�C���X�����ǂ̎��Ö�Ƃ��āA�X�e���C�h�n�R���ǖ�u�f�L�T���^�]���v�������J���Ȃ̐f�Â̎������2020�N7��21���ɒlj��f�ڂ��ꂽ�B
�@���ʂ������ꍑ���Ŏg�p���F�߂�ꂽ���Ö�́A5���ɓ��Ᏻ�F���ꂽ�u�����f�V�r���v�ɑ�����2��ځB
�@6�����p���ŐV�^�R���i�Ɋ��������d�NJ��҂̎��S�����������Ƃ̌������ʂ�����A���ۓI�ɒ��ڂ���Ă����B
�@���ɏ��F�A�ی��K�p����Ă��āA�x�̎�����d�ǂ̊����ǂ����^�̑ΏۂƂȂ��Ă���B
�@�ቿ�i�Ŏ�ɓ���₷���̂����_�Ƃ���Ă���B
�����f�V�r���@�������̃R���i���Ö�i2020�N5���j
�@�����f�V�r���́A�ĐH�i���i�ǁiFDA�j��2020�N5��1���ɏd�NJ��҂��ً}�g�p�����������B
�@�܂��A�u�����f�V�r���v���J�������ăM���A�h�E�T�C�G���V�Y���A�����J���Ȃɖ��F�Ɍ������\�����s�������Ƃ�5��4���킩�����B
�@�����J���Ȃ͐R���܂ł̎葱�����ȗ������鐧�x�u���Ᏻ�F�v��K�p�B�V�^�R���i�E�C���X�����ǂ̎��Ö�Ƃ��āA�R�E�C���X��u�����f�V�r���v��2020�N5��7���A���F���ꂽ�B
�@����͈��i��Ë@��@�́u���Ᏻ�F�v�ƌĂ�鐧�x���g���āA�\������킸��3���Ƃ����X�s�[�h���F�ƂȂ����B
�@���Ᏻ�F���F�߂���ɂ͎��̂Q�̏��������K�v������B
�@�@�����̐����y�ь��N�ɏd��ȉe����^���邨���ꂪ���鎾�a���L����̂�h�����߂ɋً}�Ɏg�p����邱�Ƃ��K�v�Ȉ��i�ŁA���Y���i�̎g�p�ȊO�ɓK���ȕ��@���Ȃ����ƁB
�@�A���̗p�r�Ɋւ��A���{�Ɠ����̐����̏��F���x�����O���Ŕ̔��Ȃǂ��F�߂�ꂽ���i�ł��邱�ƁB
�@����܂łɐV�^�C���t���G���U�̃��N�`��2�i�ڂɓK�p���ꂽ���т�����A�����3��ڂƂȂ�B
�V�^�R���i�E�C���X�Ɍ��ʂ����҂���������܂Ƃ߁i2020�N4���j
| �����f�V�r�� | �G�{���o���M�̎��Ö�B�����F�B�č��ŐV�^�R���i�ł̎g�p������B���^��������53�l��68�����Տ��I���P�������B |
|---|---|
| �t�@�r�s���r�� �i�A�r�K���j |
�C���t���G���U�̎��Ö�B�x�m�t�B�����x�R���w���J���B���Y�ɒ��肵�Ă���B�V�^�R���i�E�C���X���C���t���G���U�E�C���X�Ɠ���RNA�E�C���X�ł��邱�Ƃ���A���ʂ̉\�������҂����B�َ��Ɋ�`�������炷���ꂪ����A�D�w��ɂ͎g���Ȃ��B |
| ���s�i�r���E���g�i�r�� �i�J�g�����j |
�G�C�Y�E�C���X�����ǂ̎��Ö�B�����ċz��nj�Q�iMERS�j�ł̎g�p������B�V�^�R���i�ŏ��Ȃ��Ƃ�54��g��ꂽ���A���S�����l������B |
| �V�N���\�j�h �i�I���x�X�R�j |
�C�ǎx�����̎��Ö�B���������nj������̌����Ō��ʂ̉\���������ꂽ�B10����x�g�p�B�x�������P�����Ǘ������Ă���B�����̈�Ë@�ւ��Q�����鋤��������\��B |
| �i�t�@���X�^�b�g �i�t�T���j |
�X���̎��Ö�B������w�����Ì��ʂ̉\���\�B |
�@�ʏ�A�V�������Ö���J�������F��܂ŁA����10�N�A��p1000���~������Ƃ������Ă���B
�@�����ŁA��L���̂悤�ɍ�����������]�p���Ă����̂����S�Ō����I�ł���B
�@���̒��ł��A�V�^�R���i�E�C���X���Ö�Ƃ��ėL�]���Ƃ����Ă���̂́A�����f�V�r�����A�r�K���ł���B�������A�����Ƃ�2020�N4�����_�ŗՏ��������I����Ă��Ȃ��B
�@�Տ��������I���A�V�^�R���i�E�C���X�̎��Ö�Ƃ��Ė��F��������̂́A�����ă����f�V�r����2020�N8���i�A�����J�ŏ��F�j�A�A�r�K����2020�N9���Ƃ����Ă���B
�V�^�R���i�E�C���X��@�ł݂������{�̉ۑ�i2020�N4���j
�@�V�^�R���i�E�C���X��@�ł݂��Ă������{�̉ۑ肪���̂悤�ɂQ����B
�@�@�ً}���̑Ή��̒x��
�@���{�́A�C�O�ɔ�ז�̏��F�Ɏ��Ԃ�������Ƃ����Ă���B
�@�����g�叉���̂���A�A�����J�ł̓����f�V�r���̓��^������ŋ�����Ă����̂ɑ��A���{�ł͂��̂悤�ȋً}���ł����^�ł��Ȃ������B
�@����́A�ً}���ɑΉ�����@�̐���������Ă��Ȃ����߂ł���B
�@�A�����̊C�O�ˑ�
�@����܂ŁA�����Ђł̓R�X�g�ʂ��������Ɍ������B���ˑ����Ă����B
�@����́A���{����Ô�}���̂��߁A�N�X���艿�i�i�j�����������߁A����ɑΉ����邽�ߒv�����Ȃ����Ƃł������B
�@�R�X�g�ʂ���݂�ƁA�C�O���猴�����B��������L�������A����̂悤�Ȑ��E�I�ȋً}���ɂ́A�������ł�����Ì���ŕK�v�Ȗg���Ȃ��Ȃ鋰�ꂪ����B
�@����A���S�ۏ�̖ʂŕK�v�Ȗ�ɂ��ẮA�������ł���悤�Ɍ������K�v������B
����A���u���i���������X�L�[���v������i2020�N3���j
�@���{����c�̘A����i����A�j��2020�N2��7�����u���i���������X�L�[���v�����肵���B
�@��̓I�ɂ́A�u�s��V�F�A�i���ʃx�[�X�j30���ȏ�̈��i�ɂ��āA�P�����ȏ�̌��i�������܂�鎖�āv�������s���Ɉʒu�Â��A�u���������`�[���v������B
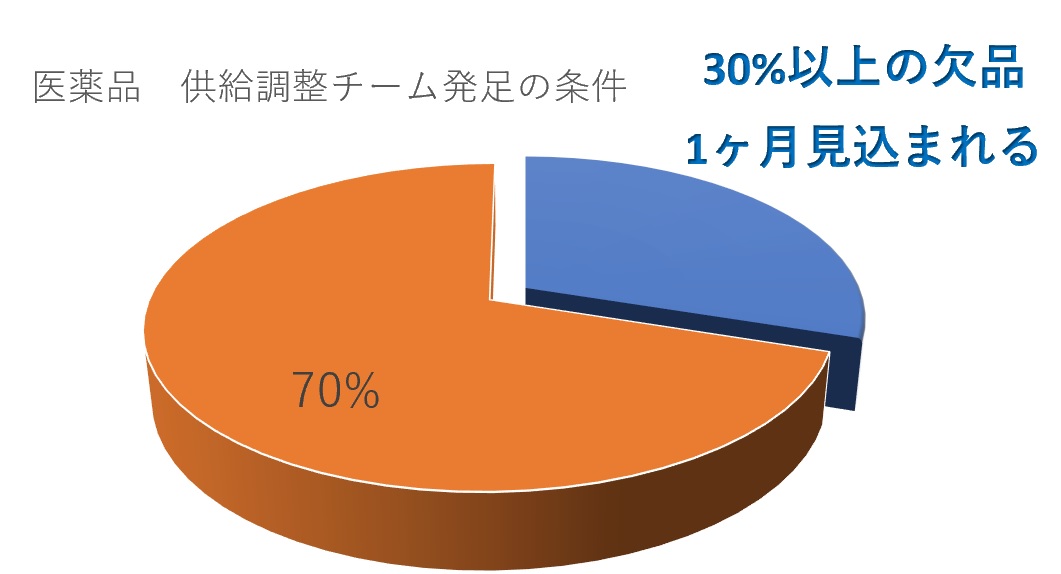
�@���������`�[���́A�����s�����������������̔��Ǝ҂̒�o���铯�ꐬ����A��֖�̃��X�g�Ɋ�Â��A������ƂŌ�������B
�@���������`�[�����[�_�[�ɂ́A�����s�����������������̔��Ǝ҂��A���B�܂��A�o�ωۂɂ��`�[���ւ̎Q������߂�Ƃ��Ă���B
�@���J�ȂƖ��ɘA�g���A��֖�̍ɂ�o�ג����Ȃǂ̑Ή�����邱�ƂŁA���苟�����p��������B
�@����͐攭�i�A�㔭�i�Ƃ��ɒ����Ő�������Ă���P�[�X�������A�V�^�R���i�E�C���X�̖��������������邱�ƂōH��̉ғ��Ȃǂւ̉e�������O����Ă���B
�V�^�R���i�E�C���X�̗Տ������i2020�N3���j
�@2020�N3�����_�ŁACOVID-19��ΏۂɗՏ��������s���Ă���̂́A
�E�R�E�C���X���f�V�r���i�ăM���A�h�E�T�C�G���V�Y�j
�E�RHIV�s�i�r��/���g�i�r���z���܁i�ăA�b���B�́u�J���g���v�j
�E�R�C���t���G���U�E�C���X��t�@�r�s���r���i�x�m�t�C�����x�R���w�́u�A�r�K���v�j
�@�Ȃǂł���B
�@���{�ł́A�������ۈ�Ì����Z���^�[�̌����ǂɂ��ώ@�����Ƃ��āA�����3��ނ̖�܂̓��^���s���Ă���B
�@�x�m�t�C�����x�R���w���u�A�r�K���v�́A2014�N�ɓ��{�ŏ��F���ꂽ�R�C���t���G���U�E�C���X��B

�@�V�^�C���t���G���U�����������ꍇ�ɂ����g�p�ł��Ȃ����߁A�s��ɂ͗��ʂ��Ă��Ȃ����A�V�^�C���t���G���U�ɔ���������200���l������~���Ă���B
�V�^�R���i�E�C���X�@���N�`���J���i2020�N3���j
�@2020�N3�����_�ŁA�V�^�R���i�E�C���X�̃��N�`���́A���E�e�n�ŋ����悤�J���̓������i��ł���B
�E�C�X���G���̌����@�ց����N�`���J���܂��u���Ɛ��J���v�Ƃ̌�����
�@�C�X���G���̌����@�փ~�K����2��27���A������������{�`�����C�ǎx���E�C���X�iIBV�j�p�ɊJ���������N�`���̗L�������O�Տ������ŏؖ����ꂽ�Ƃ̐����\�����B
�E�C�M���X�A�����A�h�C�c�A���V�A�A�I�[�X�g�����A�̌����@�ցA�A�����J�̃C�m�r�I��f���i�Ȃǃo�C�I��Ƃ���i���W�����\���E�G���h�E�W�����\���Ȃǂ����N�`���J���ɏ��o���Ă���B
�@���ł��ăo�C�I�e�N�m���W�[��Ѓ��f���i�̐V�^�R���i�E�C���X���N�`�������A�q�g�ɓ��^���鎎����2020�N3���J�n���������B�e�Ђ����N�`���J����i�߂钆�ŁA���Ђ���ԏ��Ƃ݂���B
�E�����Ёu�A���W�F�X�v������w�A�^�J���o�C�I�Ƌ����ŁA�V�^�R���i�E�C���X�ɑ���DNA���N�`���Ǝ�������J�����邱�Ƃ\
�@DNA���N�`���́A��ʓI�ȃ��N�`�������Z���ԂŐ����ł���Ƃ����B
�@���݁A���N�`�������Ă���i�K�ŁA����A���������Ȃǂ��s�������ƁA�ŒZ��6�J���ȓ��ɗՏ��������n�߂����l���B