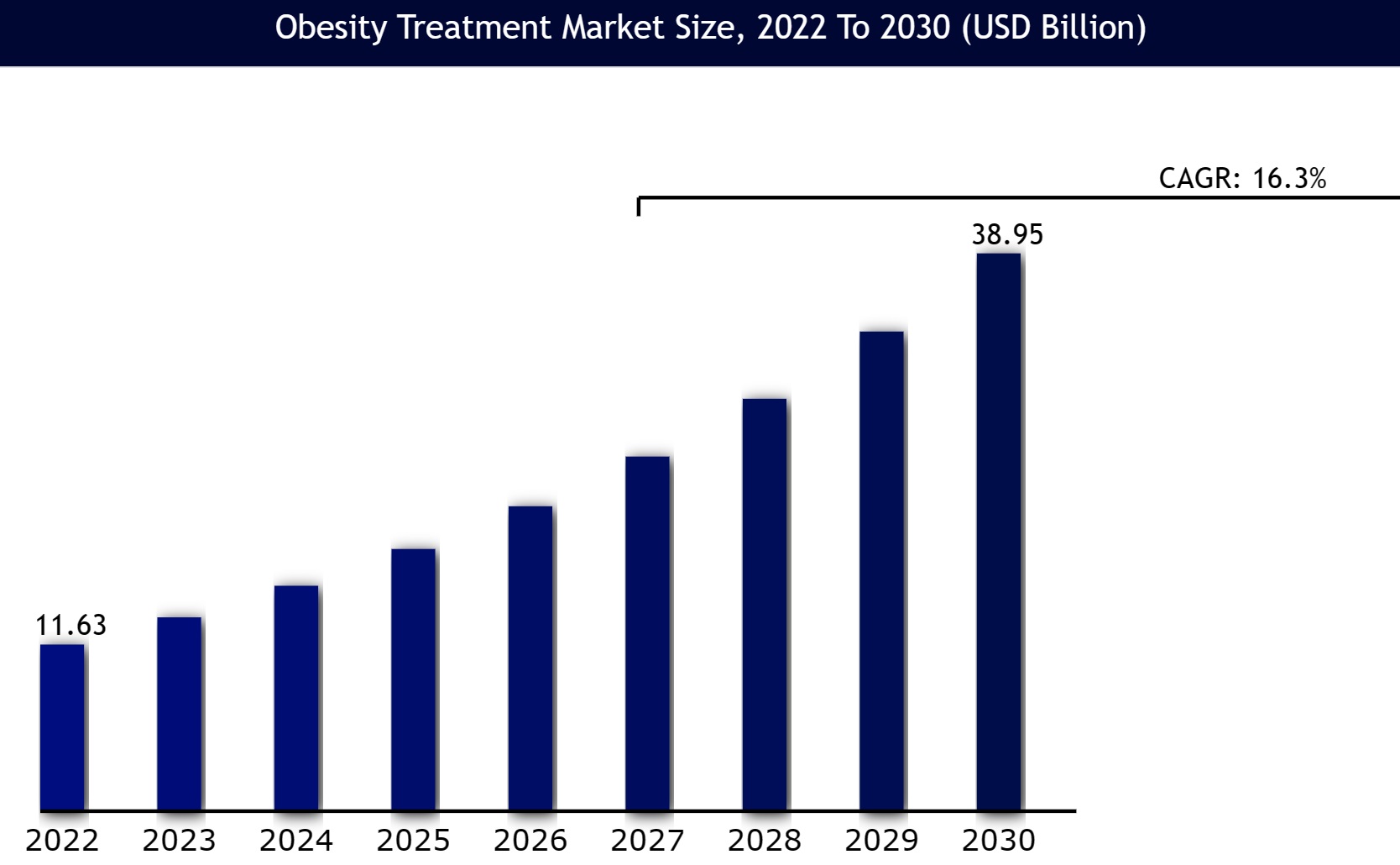
�W�F�l���b�N���i�̋����s���Ƃ́I�H
�@2023�N8�����_�ŁA���i�̖�2���ɓ������4000�i�ڂ������s���Ɋׂ��Ă���B

�@��̋����s���͕č��Ȃǂɂ����邪�A�o�ג�������͔̂N�ԂŐ��\�i�ڒ��x�ł���B����i�ڂɂ��y�ԓ��{�̋����s���ُ͈�ȏł���B
�@�Ƃ��ɑ���Ȃ��̂��u���W�R���v�u�A�X�x�����v�u�A�X�g�~���v�u�t�X�R�f�v�u���X�v�����v�Ȃǂ���Ë@�ւň����قڑS������P�܁i�����~�߂̖�j�������i႐��j�ł���B
�@�����~�ߖ�́A��×p���i�����łȂ��s�̂̍ɂ��Ȃ��Ȃ��Ă���B
�@�܂��A�s�����Ă����8�����W�F�l���b�N���i�ł���B
�@�R���i�ЂŊ����ǑO�ꂳ�ꂽ�e���ŁA3�N�ԃC���t�����s�͍ŏ����ɗ}�����Ă����B
�@������2023�N5���̐V�^�R���i��5�ވڍs�ɂ���ē��{�e�n�ɃE�C���X�����s�����B
�@2023�N�Ĉȍ~�́A�V�^�R���i�E�C���X��C���t���G���U�A���ׂȂǂ̊����ǂ̊��҂��������B
�@�Ƃ��ɐ[���Ȃ̂��q�ǂ��p�̖�ŁA�y�j�V�����n�̍R���܂�����Ă��Ȃ��B
�@�W�F�l���b�N���i���s�����n�߂��̂́A2020�N�i�ߘa2�N�j12���ɔ��o�����A�W�F�l���b�N���i���[�J�[�u���щ��H�v�̕s�ˎ������[�ƂȂ��Ă���B
�@�������Ö�Ȃǂɐ��������܂̐������������A240�l�ȏ�Ɍ��N��Q�����������B
�@���̎��������������ɁA�W�F�l���b�N���[�J�[�́u����H�v�Ȃǂ̐����H���ŕs�������o���A13�Ђ��Ɩ���~���߂Ȃǂ̏��������B
�@���̌���A�����̌㔭��ŕi���s����������A�o�ג�~��̔����~�Ɋׂ����B
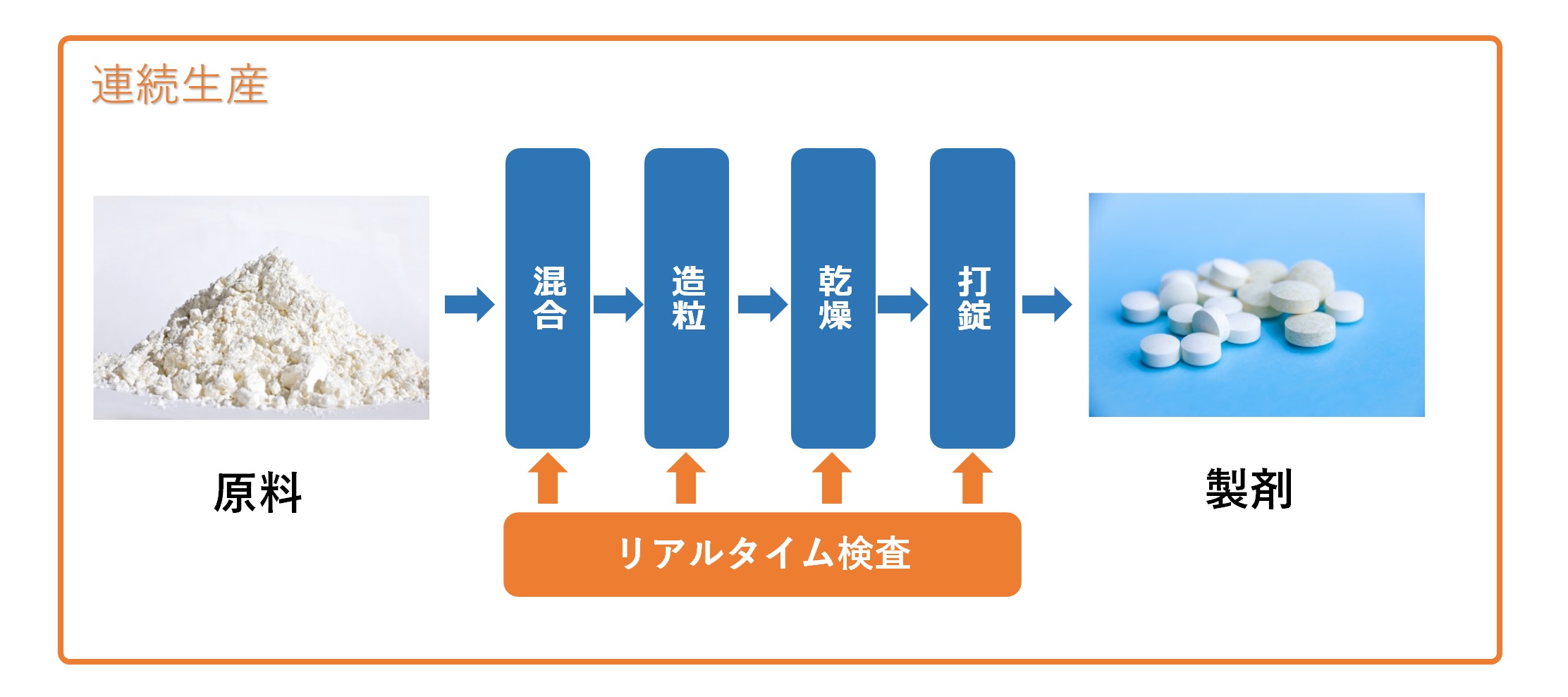
�@�㔭���i�s��̋}�g��̒��ŁA���}���������߂ɁA���Y�g���}��W�F�l���b�N���i��Ƃ̈ꕔ�Łu�i���Ǘ��E�����Ǘ��v�ɑ���Ǘ��Ɠ�������a���ɂ����ƌ��킴��Ȃ����Ԃ��������B
�@�܂��A�W�F�l���b�N���[�J�[�͌���ꂽ�������C���Ő������̕i�ڂ����ʐ��Y���Ă��邽�߁A���Ђ̏o�ג�~���߂邾���̑��Y�͂ł��Ȃ��B
�@�u���i��E���ʐ��Y�v�Ɋׂ�ɂ͖���B��͒����s��ɂ���i�ڂقlj��i�������邽�߁A�V�����i�ڂ����X�ɔ������Ă����Ȃ���A���v���o�������邱�Ƃ��ł��Ȃ��ƊE�\���ƂȂ��Ă��邩��ł���B
�@����ɁA���{�͊C�O�ɔ���K�̓��[�J�[�������A1�Ђ������s���Ɋׂ�Ƃ����܂����Ђւ̃V���őS�̂���������B
�@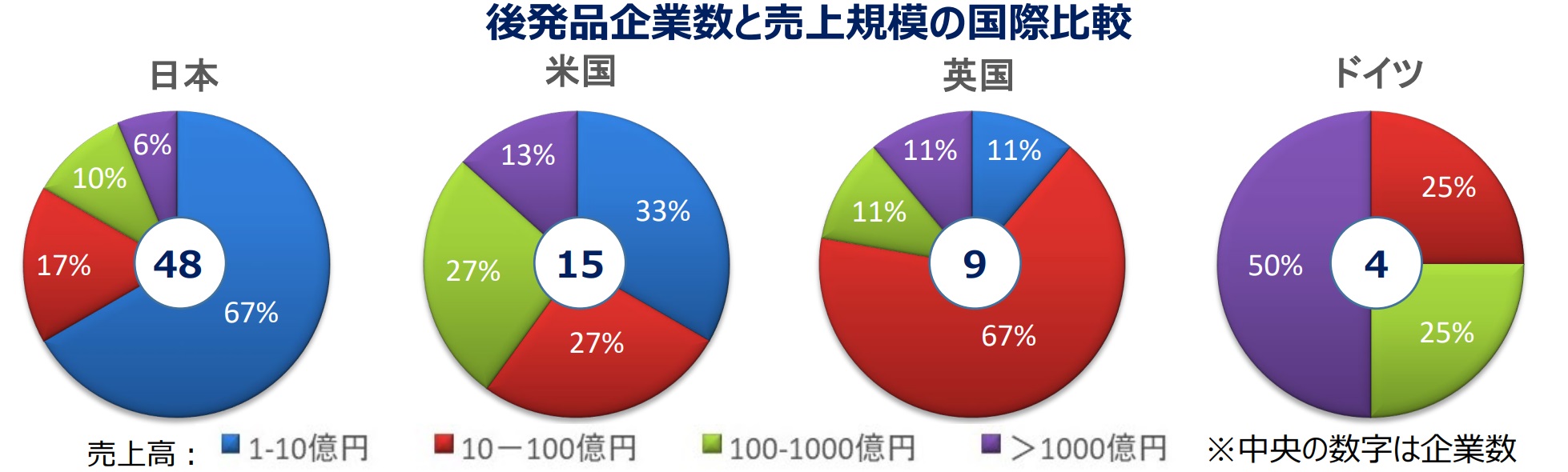
�@�ƊE�ĕ҂��ȒP�ł͂Ȃ��B�㔭��͑S�̖̂�3���̂P���Ԏ��Ɋׂ��Ă��邽�߁A��������ɂ��Ă��s�̎Z�i�ڂ͈��������Ȃ��Ƃ����������B
�@���ۂ�2020�N�ɑ�䐻�i���s���̂��������щ��H���琶�Y�ݔ��Ɛl������������A�i�ڂ�ɂ͈����p���Ȃ������B�s�̎Z�̖�܂ň�����̂���������B
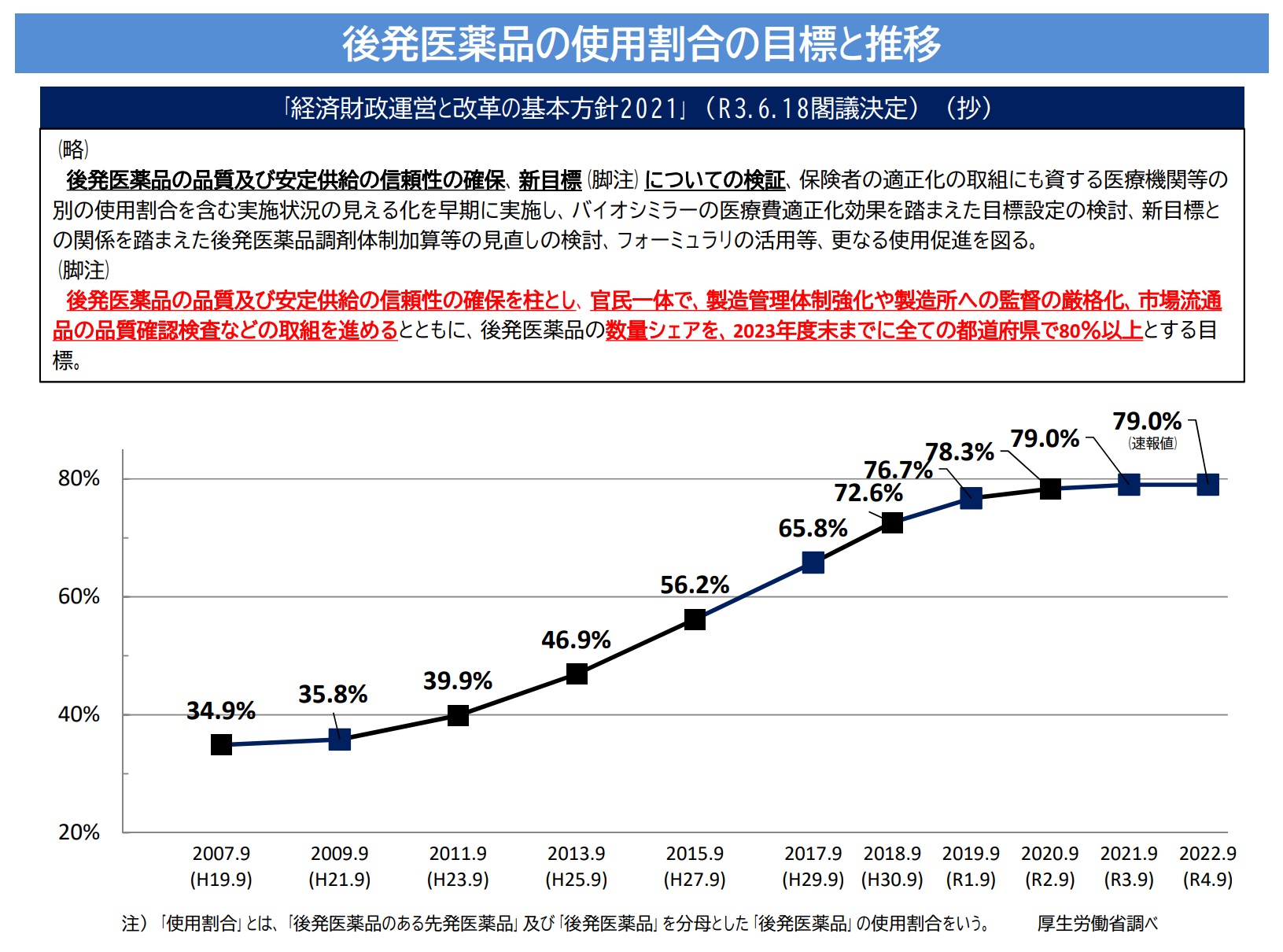
�@���{�́A��Ô�팸�̂��߃W�F�l���b�N���i�̎g�p�𑝂₵���a�@�E��ǂɋ��K�I�C���Z���e�B�u��t�^����u�W�F�l���b�N���i�g�p���i��v�𐄂��i�߂��B
�@���ʁA�W�F�l���b�N���i�̎g�p�����́A�ق�8���ƂȂ��Ă���B
�@
�@����ɉ����Đ��{�́A��Ô�팸�̂��ߖ����𐄂��i�߁A��̉��i�������������Ă���B
�@����͏]���A2�N�u���ɍs���Ă������A2021�N�x����u���ԔN�v���܂߂Ė��N�s���Ă���B
�@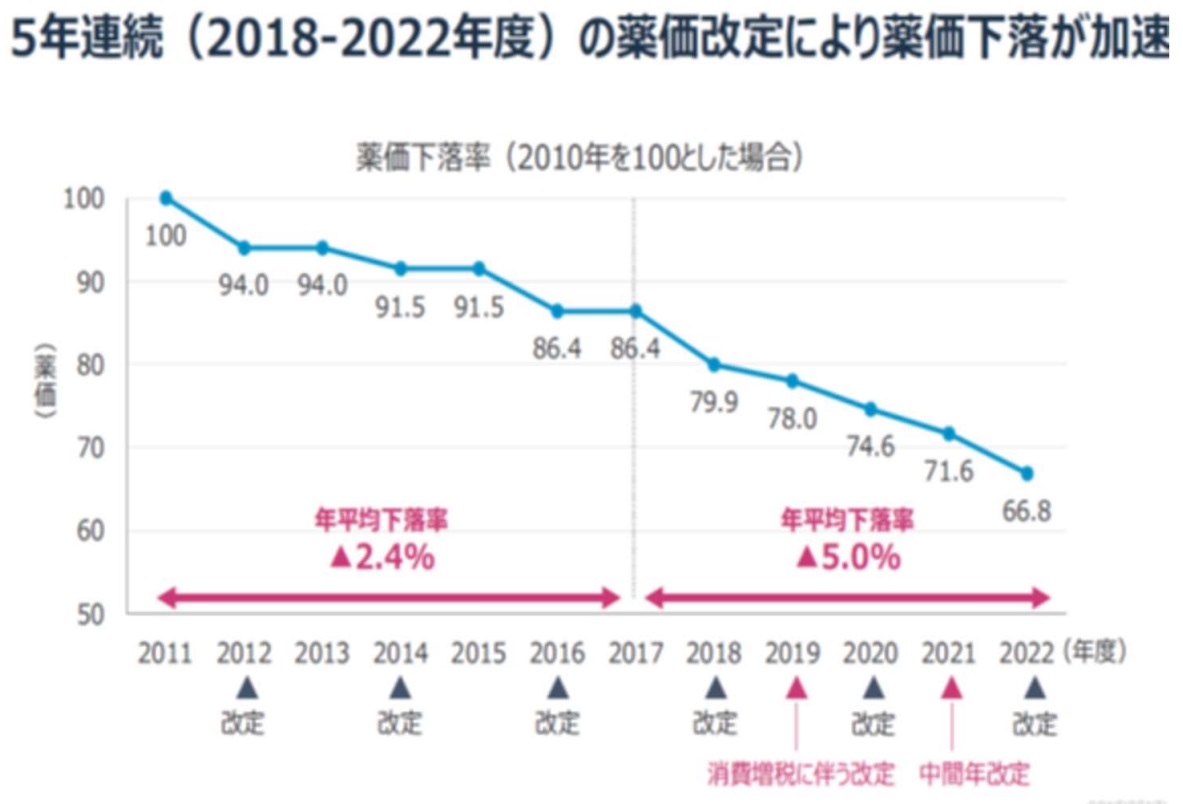
�@�W�F�l���b�N���[�J�[���u��䐻��v�̖ؑ��В��ɂ���2023�N���_��3�����炢�̐��i���Ԏ��ɂȂ��Ă���Əq�ׂĂ���B
�@������ʏ����ɋ߂������������N�s����W�F�l���b�N���i��Ƃ͊�Ƃ̋K�͂��킸�����s���Ȃ��Ȃ�B
�@
�@�������A������Ô�̑��傪���̍������������鍡�A�㔭��̖��グ��Γ��R�A��ȁi��t�j�̐f�@��V�̈�����������������邱�ƂɂȂ邪�A�Ҕ������\�z���ꌻ���I�ł͂Ȃ��B
�@���{�͈ꎚ���A���F���ǂ���ɖ�����Ȃ�������Ȃ��Ƃ������ۓI�Ɍ���ƈٗl�ȃ��[��������A�s�K�v�ȏo�ג�~�������Ă���B
�@��̏��F���ɂ́A�������ۂ̉��x��A�ǂ̏��ԂŌ����������邩�Ƃ������ׂ₩�Ȃ��Ƃ��L�����B���Ă͏��F���Ɛ������Ԃ̈�v�����������߂��邱�Ƃ͂Ȃ������B
�@�������A2015�N�ɉ��w�y�����Ö@�������i�������j���A�������F���Ă��Ȃ����@�Ō��t���܂������ׁA���F���Ƃ̈�v�����������߂���悤�ɂȂ�A2021�N�̏ȗ߂Ŗ��������ꂽ�B
�@���ď����ł́A�����Ђւ̍��@�ɂ���Ė�肪���o���Ă��A���N�ւ̉e����]�����āA�l�̂ւ̃��X�N���Ⴍ�A���S���ɖ�肪�Ȃ����Ƃ��m�F�ł���Ɩ���~�ɂ����A�o�p����������d�g�݂�����B
�@����ɑ��A���{�͏��F���ƕs��v��������ΕK���������B���@��̌y���������w�E����A�Ɩ���~�����������[�J�[������B
�@����͔����I�Ȗʂ�����A����ɌŎ�����K�v���Ȃ��Ƃ�������������B
�@����������ł����@�ŁA�������郁�[�J�[��������\��������B�@
�@�W�F�l���b�N���i�̋����s���̉����ׁ̈A���L�̑l������B
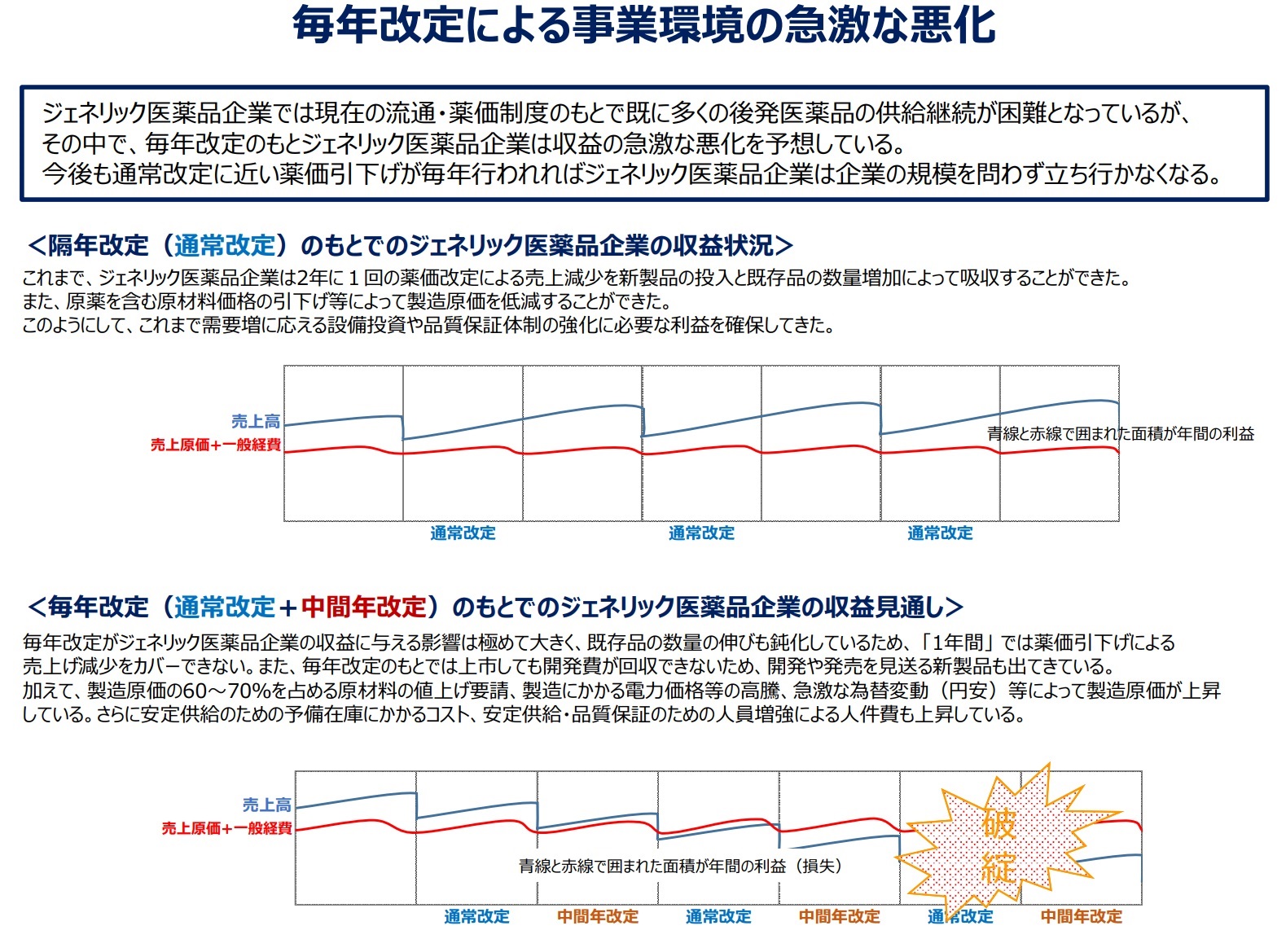
�@���萧�x�̌������F���������㔭���i�͉��i���������߁A�W�F�l���b�N���[�J�[�͗��v���o�ɂ����B����āA����ȏ��������A�o�c�����������Ȃ��Ȃ�B
�@�i�����ŗD�悷��̐��̋����F�����Ђ͈��i�̐����Ǘ��E�i���Ǘ��̐��iGMP�j�A�i���ۏؑ̐��iGQP�j�y�ш��S�Ǘ��̐��iGVP�j�̈�w�̋�����}�邽�߂̎��g�݂��K�v�ł���B
�@�ƊE��Ԏ��i�ڂ̍ĕ��F�C�O�ɔ�ׁA���K�͂��������{�̈��i���[�J�[�̋ƊE�ĕ҂�Ԏ��i�ڂ̍ĕ҂����߂���B
�@��Õی��̑Ώۂ���̏��O�F�����~�ߖ��A��႖�A��M���ɍ܂̂悤�ɁA�h���b�O�X�g�A�ȂǂŔ̔������s�̖�Ɠ������ʂ������։\�Ȉ��i�ɂ��ẮA��Õی��̑Ώۂ��珜�O����B����ɂ��A�W�F�l���b�N���[�J�[�̐Ԏ��i�ڂ̉����ɂȂ���B
�@�������[����i������[���̌������F�C�O���[�J�[�͓��{�̌������������[����i������[���ɂ��A���v���o�ɂ����ׁA�Q�����ɂ����\���ƂȂ��Ă���B
�@���̎x���F�W�F�l���b�N���[�J�[���A�������C���𑝂₹��悤�ɍ����x������B