���i�̘A�����Y�Ƃ́I�H
�@���i���A�����Y�Ƃ́A�����𗱂ɉ��H������A���������肷����̍H�����ڂȂ��s���������@�ł���B
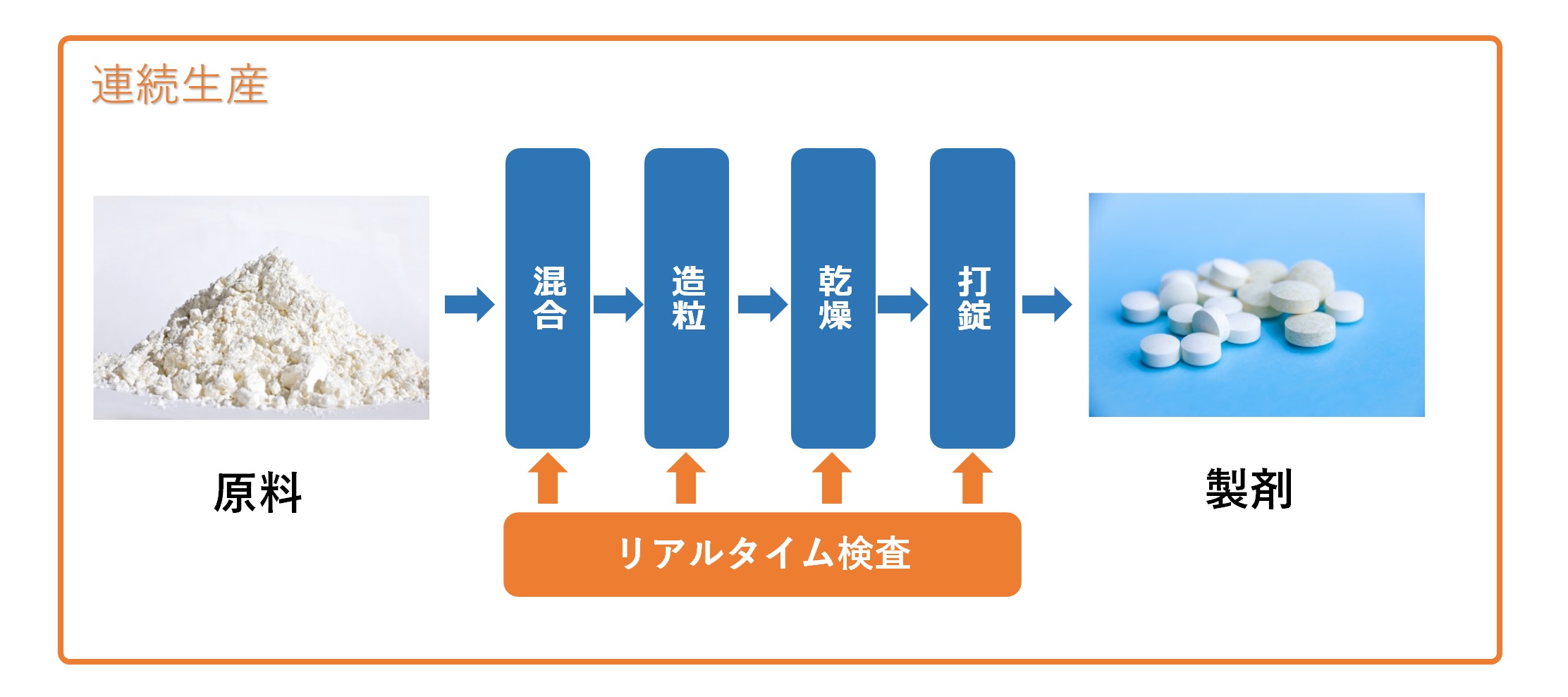
�@�l�̍�Ƃ��Ɍ��܂Ŕr�����A���A���^�C���ŕi���Ǘ����s���Ȃ���A���I�ɐ��܂�����B
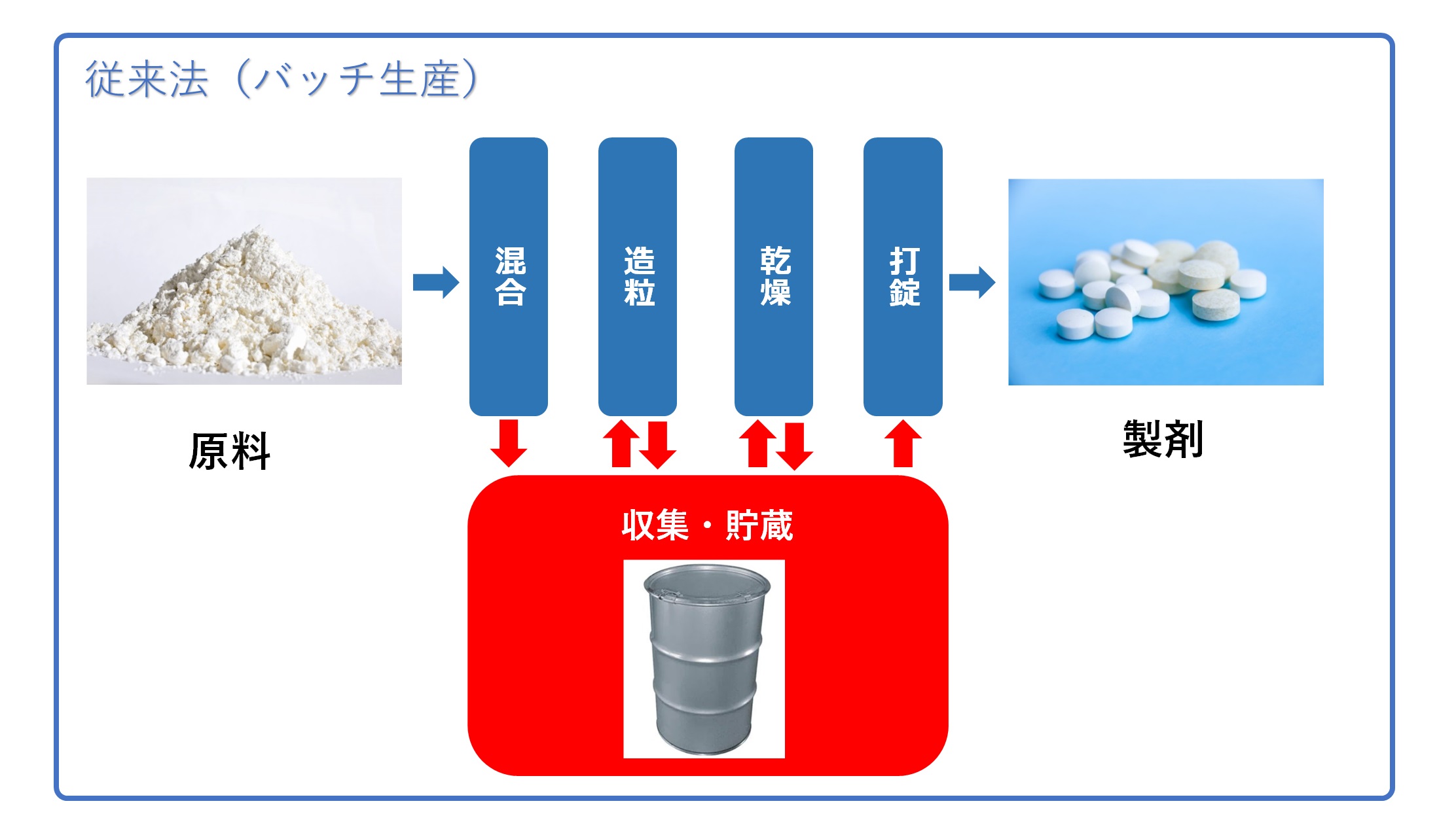
�@�]���́u�o�b�`���Y�v�ɔ�ׂāA���i���Ȑ��i�̑�ʐ��Y��H��̏ȃX�y�[�X���Ȃǂ����҂ł���B
�@�H�����Ƃɐ��Y�����@�B������o���ĕʂ̋@�B�Ɉڂ��̂���ʓI�����A�A�����Y��p�̋@�B���g�����̕K�v���Ȃ��A��Ԃ�~�X�����点��B

�@�A�����Y�̃����b�g�́A���̂悤�ȓ_������B
�@
�@�P�Ƃ̒P�ʑ��삪���Ȃ��������ꂽ�����H���������ł��邱�ƂŁA�����X�e�b�v�̃X�^�[�g/�X�g�b�v���ɋN���肤���l�I�G���[�����炷���Ƃ��ł���B
�A�ݔ����ȃX�y�[�X���������ł��邱�ƂŁA�����T�C�g�̐ݒu�E�ړ����e�ՂɂȂ�B
�B���i�J����@�iPAT��g�ݍ���QbD�j��p���邱�ƂŁA����M�����̍����i���̈��i���ł���B
�C���v�ɉ��������̃X�P�[���A�b�v�E�X�P�[���_�E�����\�ƂȂ�A�����E�ۊǃR�X�g�̍팸�����҂ł���B
�@�f�����b�g�́A��ƂɂƂ��ē����̃n�[�h�����������Ƃł���B
�@�@�B�̒��ŗ��ꑱ���鐶�Y�������ȑ��u�Ō������A����ꂽ�f�[�^��ǂ݉������x�ȕi���Ǘ������߂���B
�@���z�̐ݔ��������l�b�N�ɂȂ�B
�y�����̃o�b�`�����Ƃ̘A�����Y�̑���_�z
| ���� | �����̃o�b�`���� | �A�����Y |
|---|---|---|
| ���ޗ��̓���/���Y���̉�� | ���ޗ���S�ʁi���͕����j���A���I�ɍH���֓����B���삪������A���Y���̎��o�� | ���ʂ̌��ޗ���A���I�ɍH���ɓ������A��莞�Ԍ�ɏ����A���Y���̎��o�� |
| �e�����H�� | �P�ʑ��삲�ƂɃX�^�[�g/�X�g�b�v�A��ƈ��̉�� | �P�ʍH����A�����A��ƈ��̉���Ȃ��Ɏ��H���ֈڍs |
| �i���Ǘ� | �H���p�����[�^�Ǘ��A�H���Ǘ������iIn line�AOn line�AAt line�����j�ARealtime Release testing�A�K�i���� | ���L�ɉ����āAIn line�������ʂɊ�Â��A��莞�ԓ��̕s�ǐ��i�̔r���� |
| �X�P�[���A�b�v | �J�����y�уo���f�[�V�����ł́A�X�P�[�����ƂɌ��؍�Ƃ��K�v�ɂȂ� | ������s�v�ƂȂ�P�[�X������A�J�����̋@��������Y�X�P�[���ƍ��킹�邱�ƂŁA���₩�Ȏ����Y�����\�ł��� |
| ���Y�{�ݖʐ� | �L�� | ���� |
�@�������A����ł͑S�H���̘A�����ɂ͉ۑ肪�����A���ʂ͈ꕔ�����H����A�����������H����L����A�o�b�`�����ƘA�����Y�̃n�C�u���b�g�^���z�肳���B
�@�A�����Y�́A���łɐΖ���H�i����ŗp�����Ă��鐶�Y���@�ł�����̂́A���i����ł͂���܂Ńo�b�`��������{�Ƃ���A�A�����Y�͎�荞�܂�Ă��Ȃ������B
�@���܊J���́A������̏��F�����Ȃ�������Ȃ��̂ŁA���т̂�������Z�p���D�܂ꂪ���ŁA�������@�̋Z�p�v�V�͋N���ɂ����ƍl�����Ă����B
�@�ߋ��ɂ�2003�N�̕č��E�H�[���X�g���[�g�E�W���[�i���Łu���i�̐����Z�p�̓|�e�g�`�b�v�X���܂̂���������v�ƕ�ꂽ���Ƃ�����B
�@�������A�č��H�i���i�ǁiFood and Drug Administration:FDA�j���A�����Y�̓������T�|�[�g�B�č���2015�N�A�A�����Y�Ő������ꂽ���i��FDA�i�H�i���i�ǁj�����߂ď��F�����B
�@�y�A�����Y�ւ̊��ҍ��ځz
�������x�ȃ��j�^�����O�Z�p�iPAT���j�Ƃ̑g�ݍ��킹�ŁA�i���s�ǂ𑁂��i�K�Ŗh�����Ƃ��\�����i���X�N�̉���ɂ��q����
���X�P�[���A�b�v�̖���������J�����Ԃ̒Z�k�ɂ��q����i�����������瓱���\�j
�����ʁE����̐����ɂ��K���Ă��遨�W�F�l���b�N���i�A�ʉ���Âւ̓K�p������
�����v�ʂɉ������_��Ȑ��Y�ʊǗ��������E�ۊǓ����R�X�g�y��������
���������̕ύX�i�����@��̈ړ��j���\�����R�ЊQ�����ɂ��A��ւ̐������̊m�ۂ��e��
�@�����ł��A���i�̐����Ɂu�A�����Y�v�����铮�����{�i�����Ă��Ă���B
�@�R�X�g�Ǝ��Ԃ̍팸��i���ۏ̐M��������Ȃǂ������b�g�ŁA���{�C�[���C�����[�̍R����܁u�x�[�W�j�I�v�Ȃ�3���i���A�����Y�ŏ��F���擾�����B
�@2020�N12���ɂ́A����`���R�C���t���G���U�E�C���X��u�]�t���[�U�v��A�����Y�Ő������邽�߂̐\�����s���A�����珳�F���B
�@�A�����Y�ɂ����i�̊J���E�����͍���܂��܂���������Ɨ\�z�����B
�@�A�����Y�ɑΉ��ł��Ȃ��ƁA�����I�ɒ��������Ȃ��Ȃ��ƌ����Ă���B
�@�����҂�Z�p�҂���Ă邱�Ƃ��d�v�B5�N��A�P�O�N������z�����������K�v�ɂȂ��Ă���B
�@PMDA�i�Ɨ��s���@�l���i��Ë@�푍���@�\�j�ł́A���i�̘A�������̍����K���̊֘A�����A�f�ڂ��Ă���B
�@�EPMDA�����{�����w��ł̍u���X���C�h
�@�E�s��������
�@


