不正製造の事例(血液製剤不正製造)
不正製造問題で、大きくクローズアップされたのが「化血研血液製剤不正製造問題」である。

2015年5月の化血研職員による公益通報(内部告発)を契機として行われたPMDAや第三者委員会による調査によって、承認された内容と異なる方法によって不正に血液製剤が製造されていたことが判明した。
1997年頃から、翌1998年以降当局による立入検査が厳格化・定期化されるとの情報を受け、当時の血漿分画製造部門の第一課長より、不正製造の発覚を回避するように指示が出され、以下のような様々な組織ぐるみの隠ぺいが行われるようになった。
製造チームにおいて、実製造の製造記録と、承認書に沿った虚偽の製造記録が作られるようになった。
偽の製造記録には、紫外線を浴びせて変色させ、作成時期を古く見せかけるなど、常軌を逸した隠ぺい工作が行われていた。
化血研第三者委員会(化血研が設置した、同所から独立する外部の委員のみで構成された委員会)により、12製品31工程に及ぶ不正製造が指摘されている。
31カ所の不整合は、承認書に記載していないヘパリンの添加、承認書と異なる量の添加剤の使用、承認書に記載された工程の一部改変・省略の3つに分類される。
第三者委員会の報告書によると、化血研においては、遅くとも1974年頃からアルブミンについて承認書と異なる製造方法が採用されるようになった。
そして、1980年代に入ると、薬害エイズ問題によって国内の加熱血液製剤の生産増強が社会的に要請される中、化血研においても早期製品化や安定供給を目的として、トップダウンのもと承認書と異なる製造方法が多数の製品において採用されるようになっていった。
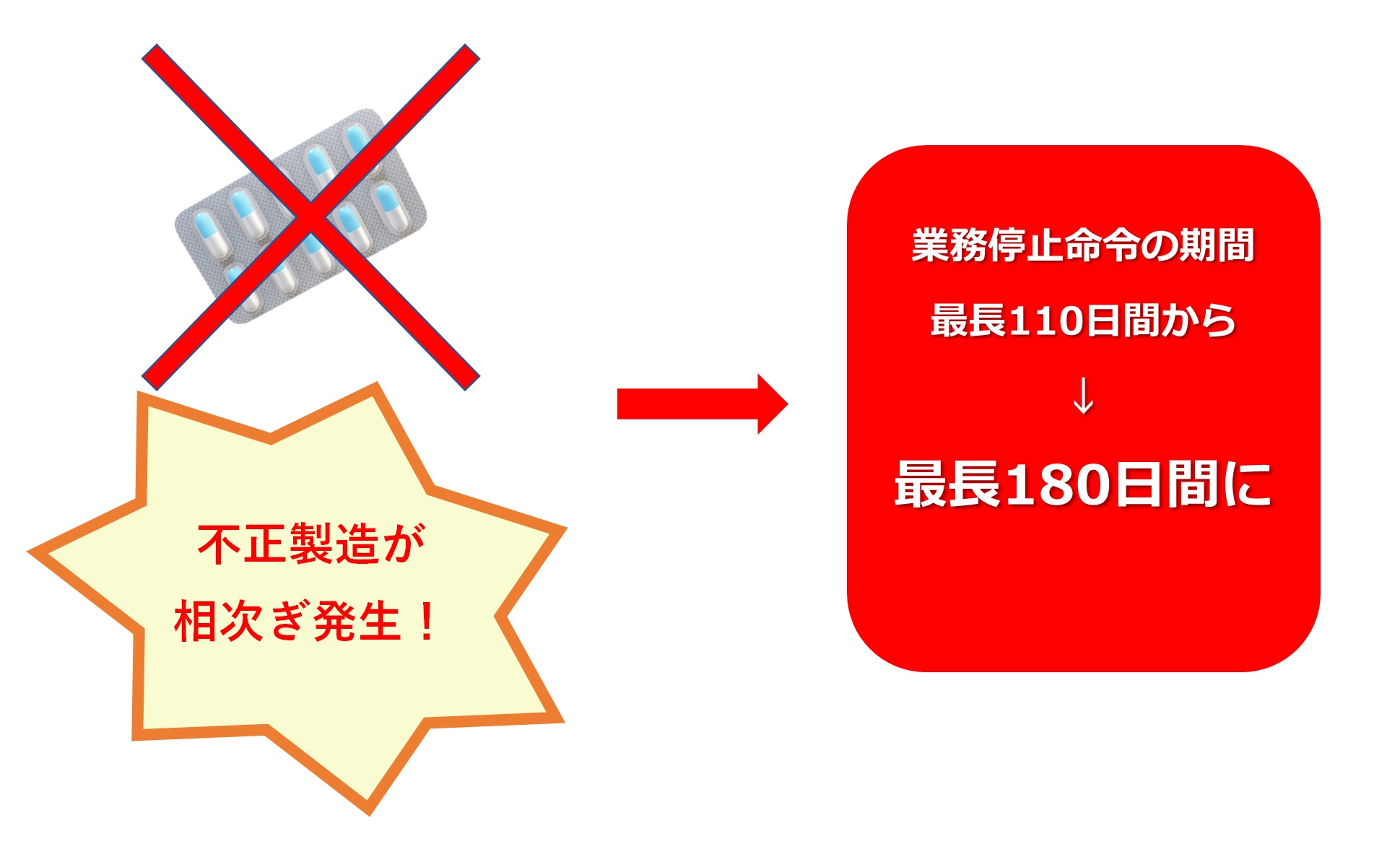
化血研は、長年にわたって血液製剤を不正製造していたとして過去最長となる110日間の業務停止処分を受けた。
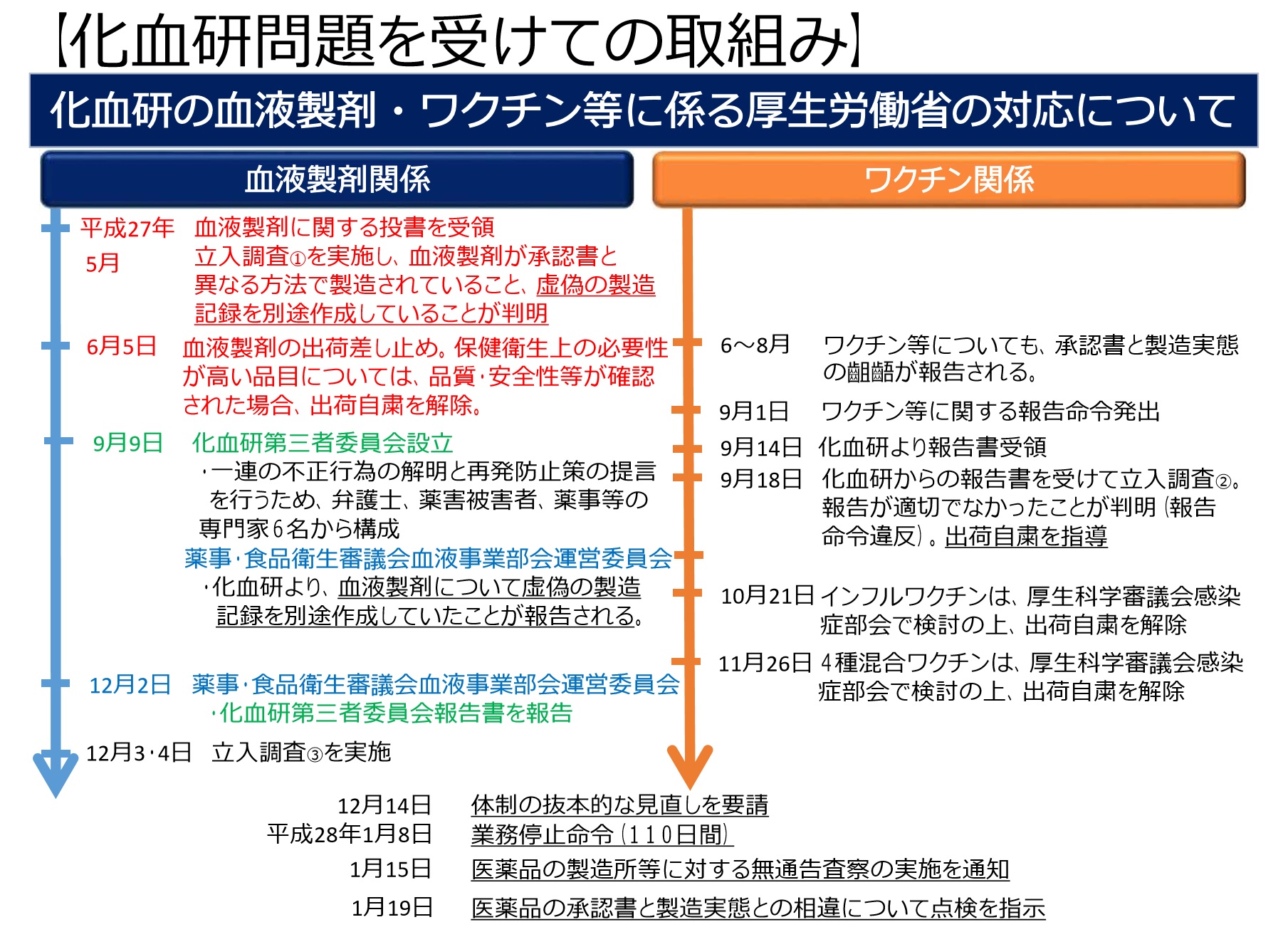
この事例は「製造実態と製造販売承認書との整合の確保」が問われ、立入調査を抜き打ちで実施するなどGMP査察体制の見直しが行われた。