不正製造の事例(後発薬手順違反)
N製薬会社は、2020年4月から21年1月にかけて延べ75品目の後発薬を自主回収した。
高血圧薬や精神安定剤の後発薬で、健康被害は確認されていないが、回収する品目数が多く、生産管理体制に問題があった。
違反は20年2月19〜21日、県と医薬品医療機器総合機構(PMDA)の工場への抜き打ち調査で発覚。
県は2年に1度、工場への立ち入り調査をしていたが、無通告査察でこれまでチェックしていなかった書類から違法処理が判明。
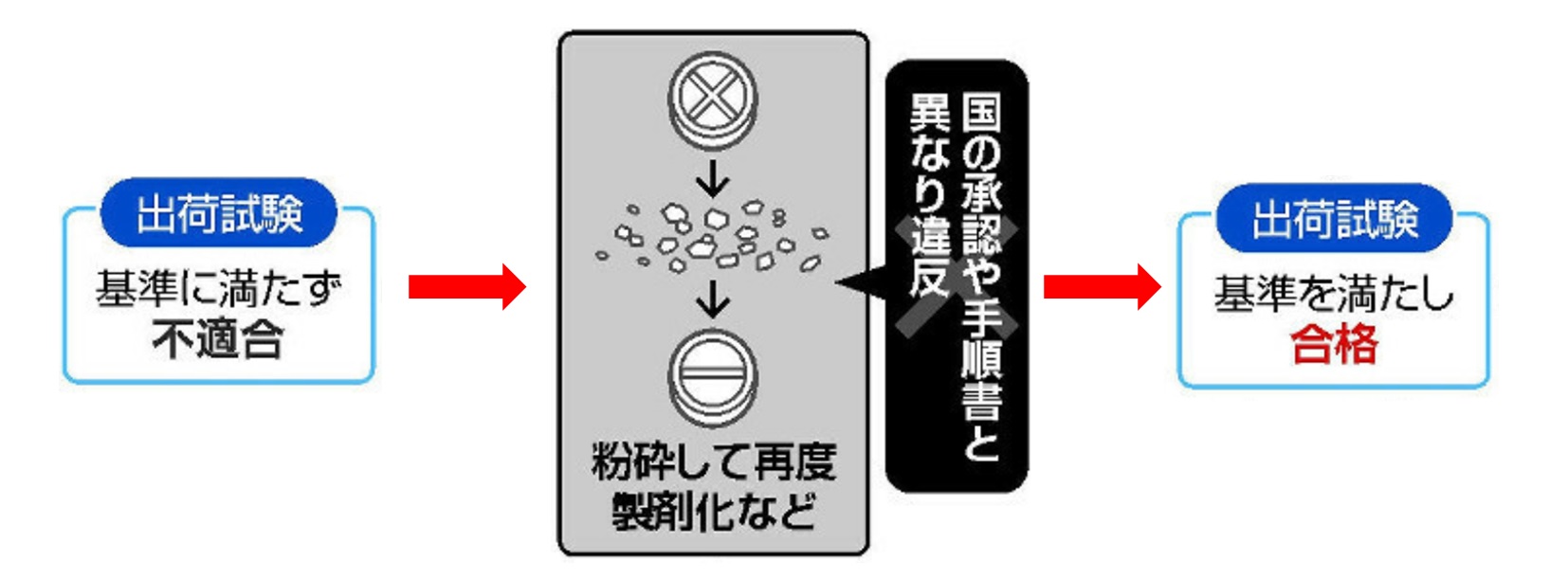
不適合になったサンプル試験の勝手なやり直しや、長期間品質が保てるかを調べる安定性試験で不適合が出た際に、出荷済み製品の回収を検討しなかったことも明らかになった。
出荷前の試験では、「不適合」だった錠剤を捨てずに再加工して試験をパスするなど、国が承認していない手順を経て「適合品」として販売した。
こうした事案は役員に報告していなかったという。
県は二重帳簿など、隠そうとした事案ではないとの認識を示しつつ「無通告の調査でなければ、見つけることはできなかった」としている。
長期保存時の品質を確かめる「安定性試験」では、溶け具合などの作用をチェックする「品質試験」で不合格となった商品を廃棄せず、国の承認を得た試験手法とは別の方法で「再試験」して出荷した。
また、錠剤を砕いて再び錠剤に加工した上で試験を通して、不適切な製造と出荷を繰り返した。
安定性試験は2009年から、出荷前の試験は2011年から違法な状態だったとした。
国の規制緩和で後発医薬品の利用が進んだことに伴い、同工場で生産量が急増。
しかし、試験に合格せず出荷できない製品が増え、社内で問題化した。
一方、品質管理を担う人員は増やされず、工場では多少の問題があっても出荷を優先する考え方が根強かったという。
社内では不合格となった製品を出荷するための会議を開くなどして、手順違反を繰り返してきた。
不正は、当時の生産本部長の指示を受け、逸脱管理責任者を兼ねる医薬品製造管理者が、逸脱会議の場で主導的に行っていた。内部では反対の声もあったというが、見過ごされてきた。
社長は「欠品、回収は営業部門への負担が大きく、生産部門が営業への配慮も含めて欠品、回収の回避を優先する風土が徐々に醸成されていた」と釈明した。
また、「事業拡大に伴い設備投資をしてきたが、現場に無理をさせすぎた」と反省した。
県が医薬品医療機器法に基づき、主力の工場に対し製造業務については32日間、本社の製造販売業務について24日間の業務停止命令を出した。
2022年の決算では、不正製造と米国事業に関連して多額の減損損失を計上したこともあり最終利益は1049億円の赤字となった。
2022年5月には、私的整理の一種である事業再生ADR(裁判外紛争解決手続き)を申請した。
2022年11月には、再建に向けて投資ファンドと医薬品卸売業の会社から支援を受けると発表。両社が出資する新会社が約200億円の第三者割当増資を引き受けて子会社化し、株式は2023年3月ごろ上場廃止となる。
また、N製薬会社の社長も第三者割当増資の払込完了日に退任する。
後発薬は低価格である一方、供給量や種類の急増にメーカー側の製造管理が追いついていないとの指摘もある。
医薬品は成分の含有量もさまざまで、一つの会社が多くの薬を作ると生産手順などで必要な基準を順守できないおそれがある。
患者の体内に直接入り、微量で作用する医薬品を扱っているという意識を、業界全体が改めて持つ必要がある。