ICHガイドラインとは!?
ICHとは、「International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use」の略称で、医薬品規制調和国際会議のことである。
ICHは、医薬品規制当局と製薬業界の代表者が協働して、医薬品規制に関するガイドラインを科学的・技術的な観点から作成する国際会議で、他に類がない場となっている。
ICHの目的は、
・新医薬品を時宜に即し、また継続的に患者が利用できるようにすること
・ヒトにおける不必要な臨床試験の重複を避けること、安全性、有効性及び品質の高い医薬品が効率的に開発、登録及び製造されること
・安全性及び有効性が損なわれることなく動物試験が軽減されること
に資する技術的要件における国際調和を促進することで、公衆衛生を促進することである。
ICHでは、医薬品の品質・有効性・安全性の各分野のトピックごとに、各メンバ−を代表する専門家が専門家作業部会で協議し、ガイドライン(科学的・倫理的に適切と考えられる指針)の作成等を行っている。
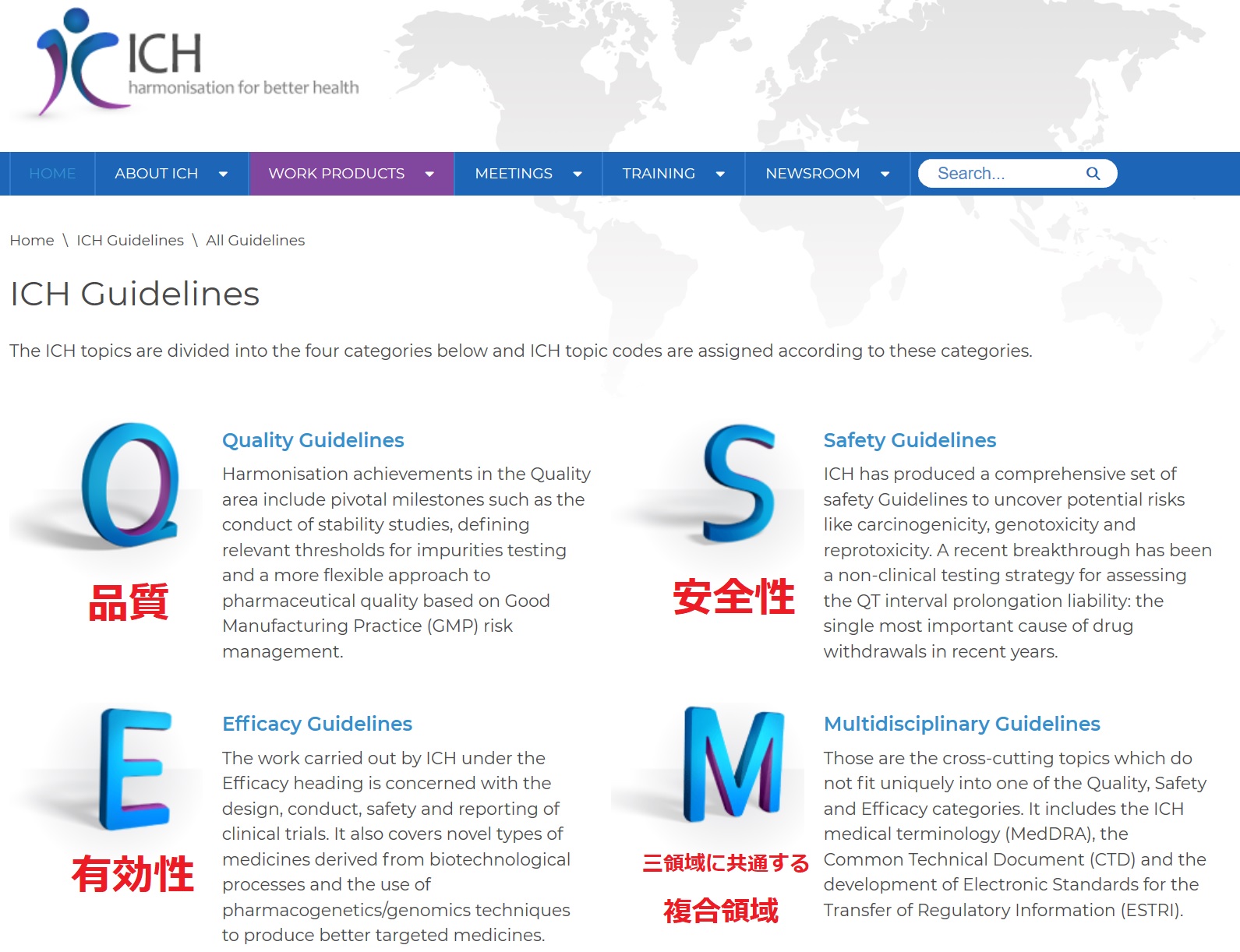
医薬品の承認に際して必要な
・品質(Quality)
・安全性(Safety)
・有効性(Efficacy)
・前三領域に共通する複合領域(Multidisciplinary)
の各領域について、専門家により構成される作業部会が科学的な議論を行う。
ICHガイドラインは5段階のプロセスによって、総会においてガイドラインが合意・批准され、各地域・国において運用されている。
ICHガイドラインは5段階のプロセスにより合意に達する。
(ステップ1)専門家によりガイドライン案が検討、作成される。
(ステップ2)運営委員会で承認されてガイドライン案となる。
(ステップ3)ICH各地域・国の規制当局(日本 : 厚生労働省)によるガイドライン案の公表、意見募集。公募意見に関して専門家作業部会で協議、ガイドライン案を修正。
(ステップ 4)修正されたガイドライン案は、運営委員会によって最終的に採択され、合意(調和)された新しいICHガイドラインが完成する。
(ステップ5)その後、各極規制当局において、それぞれの手続きに従ってガイドラインが運用される。日本では、厚生労働省から通知される。


