原材料の流れ「発注と受入れ検査」
原材料は「QA(品質保証部)が承認した供給業者」に発注する。
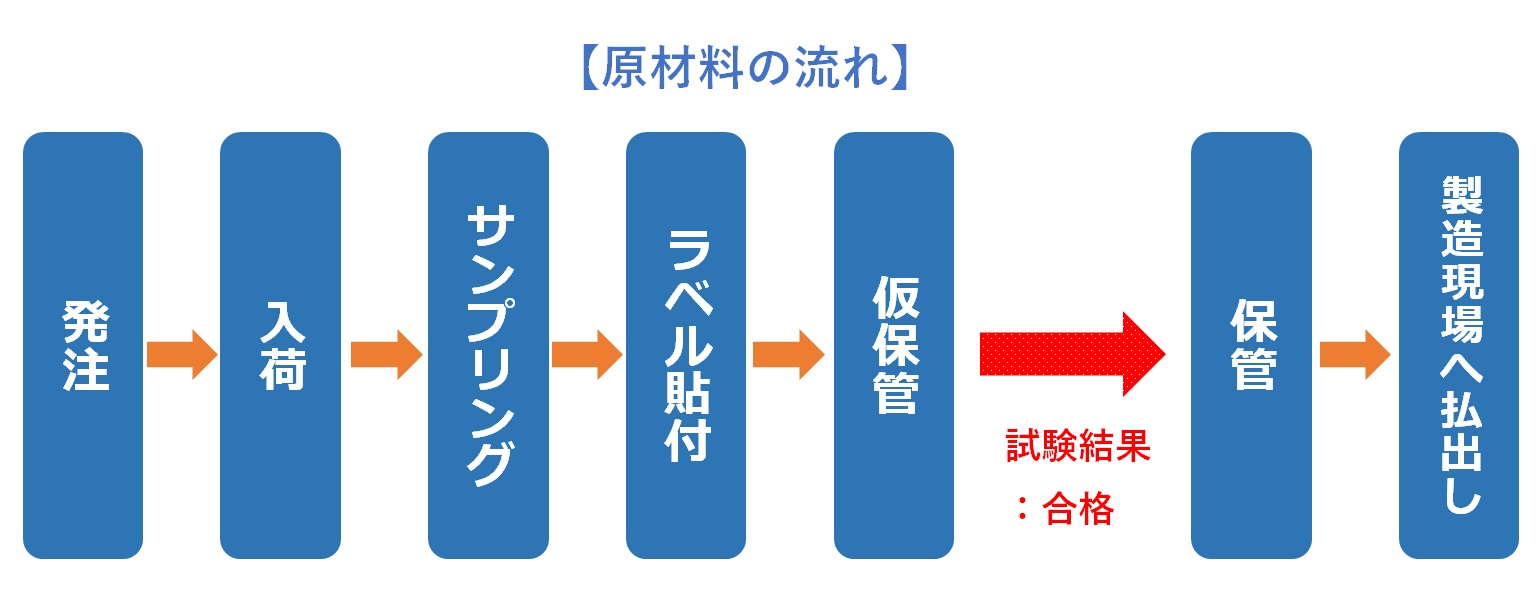
原材料が、医薬品製造工場に到着すると、入荷、サンプリング、ラベル貼付、仮保管、製造現場への払出しと作業を進めていく。
これらの作業には、それぞれSOPを作成しておく。発注から払出しまでの一連を1つのSOPにまとめるより、各作業にSOPを作成した方が良い。
各作業には、時間的、場所的な差があるとともに、担当者も異なることが多いからである。
医薬品製造では、製品製造用のすべての物質を原材料と呼ばれ、下記のようなものが含まれる。
・原料(原薬出発物質、試薬、溶剤)
・中間体(最終中間体、一般中間体)
・助剤(ろ過助剤、活性炭など)
・製造材料(ガスケット、フィルターなど)
・包装材料(ボトル、栓、袋もの、乾燥剤、ドラム、ダンボールなど)
・表示材料(ラベル、識別材料など)
・原薬 等
発注は、承認された原材料供給業者に発注する。
供給業者への発注は、同一品質の原材料入手体制確立が目的である。
原材料供給業者および自社購買部の協力を得て実施し、原材料供給業者の評価・承認はQAが行う。
監査実施のためのSOPとチェックリストを作成しておき、必要ならトレーニングを受けた監査者による原材料供給業者の訪問監査を行う。

原材料供給業者とは、品質保持の覚書を交換し、購入開始後は定期的な品質チェックを行う。
尚、重要度の低い原材料の供給業者は、平易な供給業者決定と発注管理をすることができる。
原材料の入荷は、あらかじめ決められた入荷場所に入荷品を運び込んで、受入れ検査を実施する。
受入れ検査では、発注書と照合して、発注品と相違ないことを確認する。
出荷元分析表の存在を確認した後、試験項目および試験結果が品質合格判定基準に合致していることを確認する。
出荷元のラベル表示、容器の破損、封かん状態、添付されている資料の完全性(書換えなし等)、汚染の有無等の外観目視検査をし、すべてに合格すれば受入れ合格となる。
分析表に異常が見つかったり、包装材が破損していたりした原材料が見つかれば、受入れ不合格とし、誤使用を防ぐため不合格品置き場に速やかに移動する。
入荷品の合格、不合格に関わらず、原材料受入れ台帳に今までの作業内容を記入する。
タンカー、タンクローリー、往復ドラムのような大型容器で、専用使用でないものは、洗浄証明書や微量不純物試験書の結果を見て、前輪送物資との交差汚染が発生していないことを確認したのちに受入れ作業を開始する。