�o���f�[�V�����Ƃ́I�H
�@�������ꂽ�ЂƂЂƂ̈��i���S�Ė��Ȃ����̂ƒf���ł���ł��낤���B

�@�����������i�����ׂĊJ�����Č������A���i���m�F���邱�Ƃ͂ł��Ȃ��B�������A�����ۏ��Ȃ��Ă͈��S���Ĉ��i�����邱�Ƃ��ł��Ȃ��̂ł���B
�@�����ŁA���i�����������Ƃ��Ă��A�v���Z�X����������肵�ĉғ����A�\�������i���̐��i�����Y�ł��邱�Ƃ��Ȋw�I��@�ɂ��ؖ����邱�Ƃ��A�������d�v�ƂȂ�B
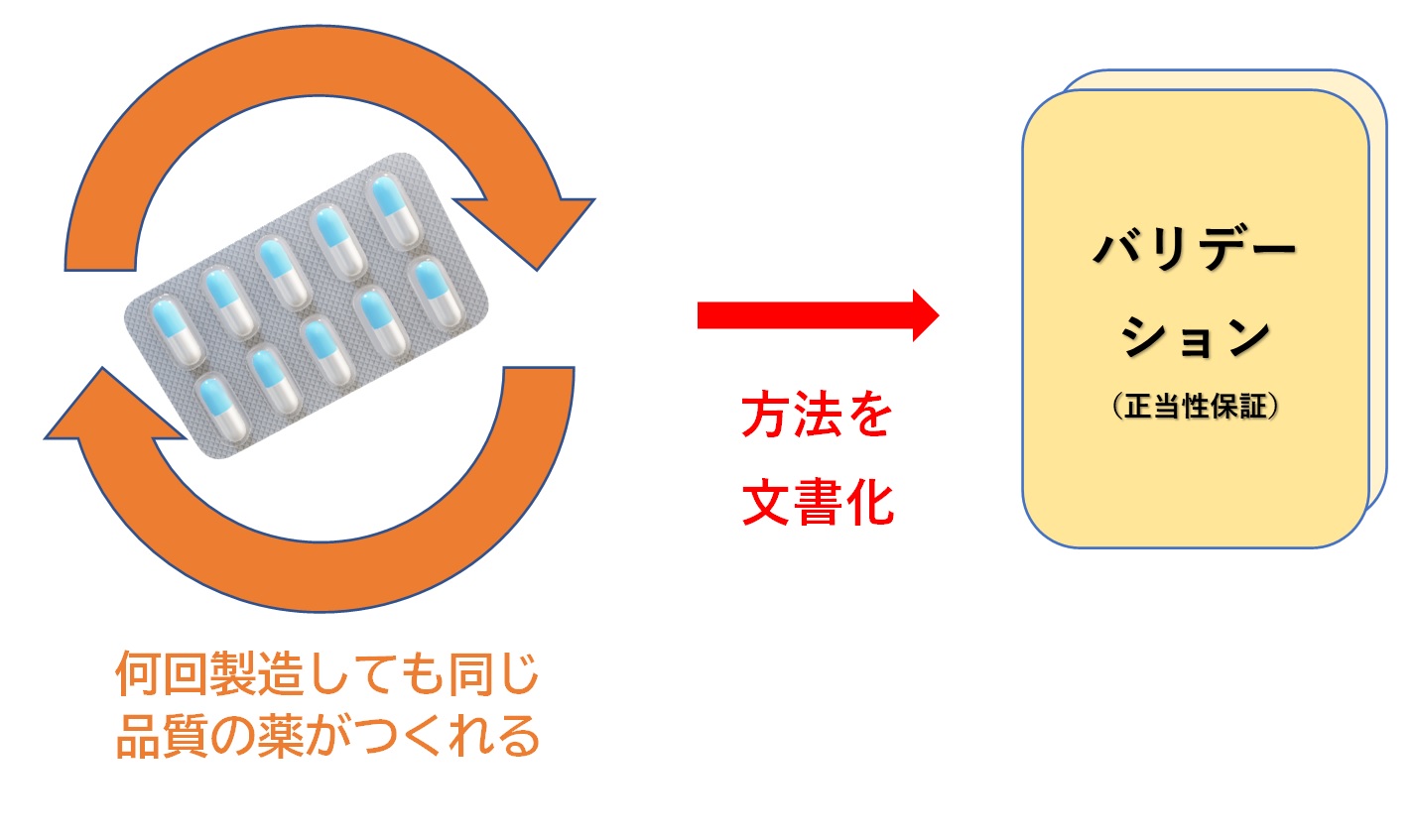
�@�o���f�[�V�����́A��ʂɁA�u���炩���ߌ��߂�ꂽ�K�i�ƕi���ɍ��v���鐻�i���P��I�ɐ�����������Ƃ����x�ɕۏ��A����������邱�Ɓv�ƒ�`�����B
�@���i�̐����ߒ���i���Ǘ��ɂ����āA�ݔ��A�H���A�菇�Ȃǂ��A���҂���錋�ʂƂȂ邱�Ƃ��Ȋw�I�����Ɋ�Â������A����������āA�����������i���i������������B
�@�܂�A���i�̕i���������悤�ɂǂ�ȏ����Ő������邩�A���𑪒肷��悢�̂��A����f�[�^�̂���͋��e�͈͂��Ȃǂ��������A�Ȋw�I�Ó������S�ۂ��ꂽ�������������肵�Ă������Ƃł���B
�@���i�ƊE�ɂ����ăn�[�h�E�F�A��v�A���삵�A���n�����t�����s���A�ݔ����ғ�������ۂɂ́A���̊e�X�e�b�v�ɂ����ăo���f�[�V�������K�v�ƂȂ�B
�@�P�A�����H��
�@�Q�A�������x������V�X�e��
�@�R�A��̍��
�@�ݔ��܂��͋@��P�ʂ��Ƃ̃o���f�[�V���������߂���B
�@�܂����{�ł́A�o���f�[�V���������{����ꍇ�ɂ��Ĉȉ��̂R�ƒ�`���Ă���B
�@�@�V���Ɉ��i�̐������J�n����ꍇ
�@�A�����菇�����i�̕i���ɑ傫�ȉe�����y�ڂ��ύX������ꍇ
�@�B���̑������Ǘ��y�ѕi���Ǘ���K�ɍs�����߂ɕK�v�ƔF�߂���ꍇ
�@�����ɊY������ꍇ�͎��Ђʼn^�p���Ă���o���f�[�V�����菇�ɏ]���A�K�ȃo���f�[�V���������{���Ȃ���Ȃ�Ȃ��B
�@��̓I�ȃo���f�[�V�����̎�ނ͉��L�̂悤�Ȃ��̂�����B
�@
�@�E�v���Z�X�o���f�[�V����
�@�E���o���f�[�V����
�@�E�x���V�X�e���o���f�[�V����
�@�E���͖@�o���f�[�V����
�@�E��o���f�[�V����
�@�E�A���̃o���f�[�V����
�@�E���ۃo���f�[�V����
�@�E�R���s���[�^�o���f�[�V�����@��
�@�o���f�[�V������@�ɂ́A���L�̃A�v���[�`�����݂��Ă���B
�@�@�\���I�o���f�[�V����
�@�\���I�o���f�[�V�����́A�H�Ɖ������̌��ʂ�ގ��i�ڂɑ���ߋ��̐������сi��������p�C���b�g�v�����g�ɂ����鐻���f�[�^�j���Ɋ�Â��āA���i�̕i���ɉe�����y�ڂ��ϓ��v���i��������ю��ނ̕����A����������j����肷��B
�@�����āA���̕ϓ��v���ɑ��鋖�e���������O�ɗ\�����A���҂���錋�ʂ��`������ŁA���̋��e�������ړI�Ƃ���i���ɓK��������i���P��I�ɐ������邽�߂ɑÓ��ł��邱�Ƃ�������B
�@���i�Y�Ƃɂ�����v���Z�X�G���W�j�A�����O�̓��[�U�[�v��������A�����W�J����ݔ��E���u�E�@�B�������\�ʂ�ɏo���オ���Ă��邱�Ƃ��N�I���t�B�P�[�V�����Ƃ��Č����邽�߁A�قƂ�ǂ����̗\���I�o���f�[�V�����ƂȂ�B
�@�A�����I�o���f�[�V����
�@�����I�o���f�[�V�����͐��i�̒ʏ퐶�Y�ɍ��킹�čs���o���f�[�V�����ł���A����ꂽ���b�g���݂̂�����ꍇ��A�܂�ɂ����������Ȃ����i�A���łɃo���f�[�g����Ă���H�������ǂ��Đ�������ꍇ�Ȃǂɗp�������@�ł���B
�@�B��ړI�o���f�[�V����
�@��ړI�o���f�[�V�����́A�ߋ��̐����L�^����ю����Ǘ��L�^���g�p���čs���v���Z�X�o���f�[�V�����ł���B
�@�ߋ��̐����ɂ����āA�i�������ƍH���p�����[�^�̎��ʂ��ł��Ă������A�H�������������{����Ǘ�����Ă������A�d�v�H���ُ�A���i�s�K���A�ݔ��s����Ȃ��������A�s�����v���t�@�C���͊m������Ă��邩������B
�@�o���f�[�V�����}�X�^�[�v�����iVMP�j�́A��K�͂ȃv���W�F�N�g�Ȃǂő����̋@���x���ݔ��������ɐ��삳���ꍇ�ɁA�o���f�[�V�����̐i�ߕ��ɂ��ĕ��j���܂Ƃ߂����̂ł���B
�@�o���f�[�V������ł́u��K�͂ȃv���W�F�N�g�̂悤�ɁA�o���f�[�V�����̑Ώ۔͈͂��L���A�ʂ̌v�揑����������ꍇ�ɂ́A�o���f�[�V�����S�̂����ĊǗ����邽�߂̃}�X�^�[�v�����̕K�v���ɂ��Č������A���̌��ʂ��L�^���邱�ƁB�v�Ƃ���Ă���B
�@VMP�̖ړI�͎��̂R������B
�@�EValidation��Ƃ̑S�̂Ƒg�D���킩��悤�ɂ���B
�@�EValidation��Ƃ̓��e�ƌv�悪�킩��悤�ɂ���B
�@�EValidation�����ׂ����ڂƃX�P�W���[��

�@VMP�́A�Ǘ��҂ɂ̓o���f�[�V���������{���邽�߂̎��ԂƃR�X�g�ɂ��āA���{����`�[�������o�[�ɂ͖ƐӔC�ɂ��āA���@���ɂ̓o���f�[�V�����ւ̃A�v���[�`�Ɛ��s�g�D�̏����ɂ��āA���̂��̂������ł���悤�ɏ����Ȃ���Ȃ�Ȃ��B